现有9g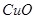 和
和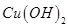 的固体混合物,与100g溶质质量分数为9.8%的稀硫恰好完全反应成不饱和溶液,则原混合物中铜元素的质量为
的固体混合物,与100g溶质质量分数为9.8%的稀硫恰好完全反应成不饱和溶液,则原混合物中铜元素的质量为
A.8g B.6.4g C3.2g D.6g
实验室用氯酸钾和二氧化锰的混合物制取氧气.某同学向10g含钾元素39%的氯酸钾和氯化钾的混合物中加入3g二氧化锰固体,加热到不再产生气体为止,则实验过程中产生氧气的质量为
| A.2.55g | B.3.2g | C.1.6g | D.7g |
在密闭容器内有氢气和氧气的混合气体80g,点燃后生成水72g,密闭容器内氢气和氧气的质量为
| A.8g, 72g | B.32g, 48g | C.16g, 64g | D.64g, 16g |
在化学反应A+B=C+D中,若12 g A与一定量的B恰好完全反应,生成28 g C和2 g D,则参加反应的B的质量为
| A.18 g | B.8 g | C.28 g | D.30 g |
15.有氮气、一氧化碳和二氧化碳的混合气体40g,其中碳元素的质量分数为30%。使该混合气体通过足量的灼热氧化铜充分反应后。再将气体通入过量的石灰水中,能得到白色沉淀的质量为
| A.30g | B.50g | C.100g | D.150g |
将含氧元素质量分数为64%的10克CO和CO2 的混合气体通过足量灼热CuO后,再使气体通入足量澄清石灰水中,可生成白色的沉淀的质量为
| A.15克 | B.20克 | C.30克 | D.40克 |
有铜铝合金8.1g放入300g溶质质量分数为9.8%的稀硫酸中,可能产生氢气的质量是
| A.0.32g | B.0.65g | C.0.84g | D.0.90g |
7 分)(1)锌片长期暴露在空气中表面会形成一层薄膜,其主要成分是碱式碳酸锌【Zn2(OH)2CO3】。若该物质通过化合反应生成,反应物除 Zn 外,还有 ①N2 ②O2 ③CO2 ④H2O中的( )
| A.一种 | B.两种 | C.三种 | D.四种 |
(2)在实验室里,小明同学设计方案用铁钉测定某废液中硫酸的质量分数。他先取一洁净小烧杯,称其质量为 18.2g,然后往其中倒入少量硫酸废液后称量,总质量为 33.2g,之后,将一枚质量为 10.8g 的铁钉(已用砂纸打磨去除铁锈)放入该小烧杯中反应,待铁钉表面不再有气泡产生后,再次称量,总质量为 43.9 g。请回答下列问题:
①反应中产生的气体的质量是 g。
②计算该废液中硫酸的质量分数(写出计算过程,计算结果保留一位小数)。
③如果铁钉的铁锈未除净,对硫酸的质量分数的计算结果的影响是“偏大”“偏小”、 无影响”),理由是 。
将6.96 g铁的某种氧化物在高温下与足量的一氧化碳充分反应,生成5.28 g二氧化碳,则这种铁的氧化物应该为
| A.FeO | B.Fe2O3 | C.Fe3O4 | D.无法确定 |
学校实验室内有瓶放置时间较长的过氧化氢溶液,为测算该溶液中过氧化氢的质量分数:现取50g样品,加入2g MnO2完全反应后,剩余物质质量为50.4g。
计算(1)生成氧气的质量。
(2)样品中过氧化氢的质量分数。
一氧化碳和二氧化碳的混合物10克,通过足量的炽热的氧化铜,充分反应后所得气体的质量为11.6克,则原混合物中二氧化碳的质量为 ( )
| A.5.6克 | B.4.4克 | C.7.2克 | D.2.8克 |
将 铁和碳的混合物在氧气中充分灼烧,冷却,称量,发现剩余固体的质量仍为 ,该混合物中碳的质量分数为( )
| A. | 30.0% | B. | 22.2% | C. | 27.6% | D. | 10.3% |
某合金6g与足量的稀硫酸充分反应后,如果生成0.2g氢气,该合金中的元素可能是( )
| A.Zn和Fe | B.Cu和Au | C.Zn和Cu | D.Mg和Al |
已知反应A+2B==C+2D,8gA与足量的B恰好完全反应生成22gC和18gD,D的相对分子质量为18,则A的相对分子质量为( )。
| A.8 | B.18 | C.22 | D.16 |
将一定质量的高锰酸钾放在试管内加热一段时间后,测得反应后生成氧气的质量小于原高锰酸钾质量的10%,则反应后的固体物质与原高锰酸钾的质量比可能是
| A.71︰75 | B.71︰79 | C.80︰79 | D.81︰79 |
试题篮
()