高纯的单晶硅是重要的半导体材料。制备高纯硅的化学方程式为:SiCl4 +2H2高温 Si+ 4HCl。请计算要获得56g硅(Si),至少需要氢气的质量。
某铁合金5.8g,与足量的稀硫酸充分反应,得到0.2g的氢气。请计算:
(1)该合金中铁的质量是多少克?
(2)该合金是生铁还是钢?(已知:生铁的含碳量是2%—4%,钢的含碳量是0.03%—2%)
对于化学反应:2A =" 2B" +C,已知:反应生成B和C的质量比为B∶C = 1∶8。请填空:
| 物质 |
A |
B |
C |
| 反应前质量/g |
100 |
0 |
5 |
| 反应后质量/g |
64 |
|
|
在实验室中做硫在氧气中燃烧的实验,会生成有毒的SO2气体。
(1)为防止造成污染,进行实验时,可在集气瓶里预先放少量的 吸收SO2。
(2)0.5g硫粉在氧气中完全燃烧,理论上可生成SO2的质量是多少?(请利用化学方程式计算)
造纸是我国古代四大发明之一,它有效地推动了人类文明的发展。
(1)回收农田产生的秸秆作为造纸原料,可以减少焚烧秸秆带来的污染。秸秆的主要成分是纤维素[
],纤维素中
三种元素的质量比为(用最简整数比表示)。
(2)造纸会产生大量含
的碱性废水,需经处理呈中性后排放。
①检测废水呈碱性的简单方法是。
②若某造纸厂废水中
的质量分数为l.6%,现有废硫酸9.8
(
的质量分数为20%),可以处理的废水质量是多少?(计算过程写在答题卡上)
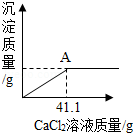
某化学课外活动兴趣小组的同学,对某化工产生产的纯碱样品(已知杂质只含氯化钠)的纯度产生了兴趣,设计实验并探究如下:①取一定质量的该样品,加55.65g水配成溶液;②向溶液中逐渐加入一定质量分数的CaCl 2溶液(实验中产生的沉淀与加入CaCl 2溶液的质量关系如图所示),当反应至A点时恰好完全反应;③过滤,测得所得滤液为100g14.35%的氯化钠溶液(实验过程中水的损失忽略不计)。试求:
(1)完全反应后,所得滤液中水的质量为 g。
(2)该纯碱样品中碳酸钠的质量分数为多少? 。(无计算过程不给分)
向盛有一定质量稀盐酸的烧杯中逐渐加入石灰石,产生气体质量与石灰石质量的关系如图所示。恰好完全反应后称得烧杯中剩余物质质量为108.1g,请根据关系图分析并计算:
(1)稀盐酸完全反应时,产生CO2气体的质量为 g,消耗CaCO3的质量为 g。
(2)该稀盐酸溶质的质量分数。(写出计算过程,结果保留至0.1%)

晶体硅(Si)是一种重要的半导体材料.冶炼硅时常用碳在高温下还原二氧化硅制得粗硅,反应的化学方程式是:
SiO2+2C  Si+2CO↑,现要制备含硅14kg的粗硅,理论上可以同时生成一氧化碳的质量是多少?
Si+2CO↑,现要制备含硅14kg的粗硅,理论上可以同时生成一氧化碳的质量是多少?
"东方之星"沉船事故的发生牵动了亿万人民的心,几百名潜水员参与了救援工作,他们佩带的水下装备中有供氧装置,其原理是利用过氧化钠与人体呼出的二氧化碳和水蒸汽反应生成氧气,反应如下:
(1)已知潜水员携带的供氧装置中装有3.9kg的过氧化钠,潜水员在水下工作时每分钟消耗氧气约为6.67g,由此求得潜水员最多能在水下工作小时。(计算结果保留整数,以上数据均为模拟)
(2)若将39g的过氧化钠与69g水充分反应(已知水在反应中过量),求算所得溶液的溶质质量分数?
硫酸厂的污水中含有硫酸等杂质(假设其他杂质不与氢氧化钙反应),可以用氢氧化钙进行处理.现有74kg氢氧化钙,可以处理掉多少硫酸?
某工厂排放的废水中含有亚硫酸钠(Na2SO3)未经处理,会造成污染,化学兴趣小组的同学对废水处理设计了如图所示的实验方案:

试计算:
(1)反应前后生成亚硫酸钙沉淀的质量为 g。
(2)废水中亚硫酸钠的质量分数(请写出计算过程)。
(温馨提示:Na2SO3+CaCl2═CaSO3↓+2NaCl;氯化钙不与废水中的其它杂质反应)
自然界的水都是含有多种物质的混合物,生产、生活中需要的纯净水可以通过蒸馏得到。
(1)将刚刚蒸馏出来的蒸馏水盛放在敞口的干净容器里,一段时间后,蒸馏水的pH将发生怎样的变化?
请你分析说明引起蒸馏水pH改变的原因。
(2)在电解水的实验中,为了增加水的导电性,常在水中加入一定量的稀硫酸。某次实验时,在一定量的蒸馏水中加入50克16%的稀硫酸进行电解,结束后测得剩余溶液的质量为100克,则剩余溶液中溶质的质量分数为多少?
氢化钙(CaH2)是一种重要的制氢剂,与水接触时发生如下反应:
CaH2+2H2O=Ca(OH)2+2H2↑.若要制得2g氢气,需CaH2的质量为多少?
某化学兴趣小组的同学在社会实践中,对废品回收站中废弃电器零部件黄铜(铜、锌合金)中铜的含量产生了兴趣,为了测定该黄铜中铜的含量,小组同学将黄铜带入化学实验室,称取该黄铜样品50克放入指定容器中,然后分四次加入稀硫酸,实验数据记录如表:
| 加入次数 |
第1次 |
第2次 |
第3次 |
第4次 |
| 加入稀硫酸质量(g) |
100 |
100 |
100 |
100 |
| 充分反应后剩余固体质量(g) |
43.5 |
37 |
35 |
n |
请回答下列问题:
(1)根据实验数据分析,n的数值应该为 ;
(2)黄铜样品中铜的质量分数为 ;
(3)所用稀硫酸溶质的质量分数。(写出计算过程)
试题篮
()