蛋白质是由丙氨酸(C 3H 7NO 2)等多种氨基酸构成的。根据丙氨酸的化学式计算:
(1)C 3H 7NO 2的相对分子质量是 。
(2)丙氨酸中各元素的质量比C:H:N:O= 。
(3)丙氨酸中氮元素的质量分数为 (结果保留0.1%)
(4)8.9g C 3H 7NO 2中含有氢元素的质量是 g。
现有一瓶部分变质为碳酸钠的氢氧化钠固体。某同学想了解其变质情况,称取10.00g上述固体样品于烧杯中,加入足量水使之完全溶解,再向烧杯中缓缓加入过量的氢氧化钡溶液,充分反应后,过滤、洗涤、干燥,得到3.94g沉淀。求:
(1)样品中碳酸钠的质量分数为 。
(2)反应后所得溶液中氢氧化钠的质量。
抗癌新药紫杉醇的化学式为C 47H 51NO 14,回答下列问题:
(1)紫杉醇的相对分子质量为 ;
(2)紫杉醇中氮元素与氧元素的质量之比为 (写出最简整数比);
(3)13.86g紫杉醇中氢元素的质量为 g。
国家对化肥的销售有明确的质量标准。为检测铵态氮肥质量的优劣,可采用铵盐与氢氧化钠反应的方法。某同学称取15g硫酸铵样品(杂质不含氮元素),与足量的 混合后,放入试管中加热,发生如下反应: 。充分反应后共收集到3.4g 。
(1) 中氮元素的质量分数 (精确到0.1%)。
(2)样品中硫酸铵的质量(写出计算过程)。
(3)合格硫酸铵化肥中硫酸铵的质量分数需达到94.3%~99%,通过计算判断上述样品是否合格?
古埃及墓穴中的壁画经历几千年依然保留着当初的神采,秘诀在于绘画的颜料采用有色的化合物如埃及蓝,主要成分是CaCuSi4O18.请回答下列问题:
(1)选物质属于 (“有机”或“无机”)化合物;
(2)该物质中铜元素与氧元素的质量比为 ;
(3)该物质中钙元素的质量分数为 (结果保留0.1%)。
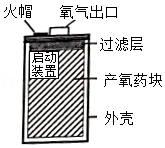
某简易制氧装置的示意图如图,其原理是通过撞击火帽触发启动装置产生热量,使产氧药块分解而持续释放氧气。
(1)装置中过滤层的作用是 。
(2)若产氧药块由氯酸钾(KClO3)和二氧化锰等组成,为得到一个人呼吸2小时所需氧气的量(折算后质量为48g),计算产氧药块中至少含氯酸钾的质量(写出计算过程)。
取95g氯化镁溶液置于烧杯中,向烧杯中逐滴滴入氢氧化钠溶液至不再产生沉淀,测得生成沉淀的质量为11.6g,计算氯化镁溶液中溶质的质量分数.
乙醇( )俗称酒精,可通过高粱、玉米和薯类等发酵、蒸馏而得到,属于可再生能源。
(1)乙醇中碳、氢元素的原子个数比是 。
(2)乙醇中碳元素的质量分数是 (计算结果精确到0.1%)。
为测定某实验废液中硫酸铜和硫酸的质量分数,分别在三只烧杯中倒入50g废液,并在烧杯中依次加入一定量的铁粉。实验结束后,测得的数据见如表:
|
第一组 |
第二组 |
第三组 |
|
|
反应前加入铁粉质量/g |
5.6 |
8.4 |
11.2 |
|
反应后剩余固体的质量/g |
3.2 |
3.2 |
6.0 |
|
反应后质量( )损失/g |
0.1 |
0.2 |
0.2 |
请回答:
(1)对比第一、二组数据,第一组实验结束后,废液中的 (填化学式)已全部参加反应;
(2)通过分析第二、三组数据,50g废液与铁粉反应生成氢气质量最多为 ;
(3)经计算,50g废液中所含硫酸的质量为 ,硫酸铜的质量分数为
硫氧粉( )可用作染漂脱氧剂,常因氧化变质生成 。向20g可能被氧化的样品中,加入质量分数为10%的稀硫酸至恰好不再产生气泡(假设气体全部逸出),消耗稀硫酸98g。已知: 。
(1)根据化学式判断 和 中钠元素的质量分数较小的是 。
(2)若用5g质量分数为98%的浓硫酸配制10%的稀硫酸,求所需水的质量。
(3)求反应后溶液中溶质的质量分数。(精确到小数点后一位)
医用碳酸氢钠片可用于治疗胃酸过多,某同学为测定其中碳酸氢钠的质量分数,取10.0g样品放入烧杯中,分两次加入稀盐酸(该实验条件下杂质不参与反应),充分反应。测定实验数据如表。
|
加盐酸的次数 |
第一次 |
第二次 |
|
加盐酸的质量g |
40.0 |
40.0 |
|
生成气体的质量/g |
3.3 |
1.1 |
(1)两次加稀盐酸后,生成二氧化碳的总质量是 g;
(2)该样品中碳酸氢钠的质量分数(写出计算过程)。(反应的化学方程式为: )
在牙膏中,常用轻质碳酸钙粉末等作摩擦剂。已知某品牌牙膏中的摩擦剂是 和 ( 既不溶于水也不与稀盐酸反应),化学兴趣小组用该牙膏的摩擦剂测定某盐酸中溶质的质量分数,通过实验测得如图数据:(假设产生气体全部逸出)

(1)生成 的质量为 g。
(2)求稀盐酸中溶质的质量分数。(写出计算过程)
碳酸氢钠俗称小苏打,在生产生活中应用广泛。
(1)如果少量的酸沾到皮肤或衣物上,常用3%~5%的 溶液处理。现用5g的 配制成溶质质量分数为4.0%的溶液,需加入水的质量是 g。
(2)某小苏打样品中混有少量 ,为了测定样品中 的质量分数,取10.0g样品加热到质量不再减小,共收集到二氧化碳2.2g, 受热分解的化学方程式为 。求该样品中 的质量分数。(写出计算过程)
为测试学生的实验和计算能力,老师准备了一瓶没有贴标签的过氧化氢溶液,同学们取部分溶液进行了如图实验,请结合实验回答下列问题:

(1)上述实验过程中发生反应的化学方程式为 。
(2)产生氧气的质量为 g。
(3)根据生成氧气的质量列出求解参加反应的过氧化氢质量(x)的比例式 。
(4)计算上述过氧化氢溶液中溶质的质量分数,并填写在答题卡的标签上(标签样式如图) 。

(5)若配制上述浓度的过氧化氢溶液300g,需要30%的过氧化氢溶液 g。
试题篮
()