今年我国“世界环境日”的主题是向污染宣战,某化工厂排放的废水中含有碳酸钠,提取50g废水样品于集气瓶中,逐滴加入10%的稀硫酸,至恰好完全反应时,收集到4.4g二氧化碳,请回答问题:
(1)判断滴加硫酸至恰好反应的依据是 。
(2)所消耗的稀硫酸质量是多少?
(3)最后所得溶液中溶质的质量分数是多少?(本小题最后结果取整数)
(1)帕拉米韦氯化钠注射液是治疗H7N9亚型禽流感的有效药物之一,帕拉米韦的化学式是C15H28NxO4。求:
①帕拉米韦中氢元素与氧元素的质量比是 (填最简比),
②帕拉米韦的相对分子质量为328,则氮元素的质量分数是 (精确到0.1%)。
(2)用“侯氏联合制碱法”制得的纯碱(Na2CO3)常含有少量的NaCl。为测定某纯碱样品中Na2CO3的含量,小明称取该纯碱样品5.5g,充分溶解于水中,再分别滴加稀盐酸至反应不在产生气体,产生气体的质量与加入稀盐酸的质量关系如图所示。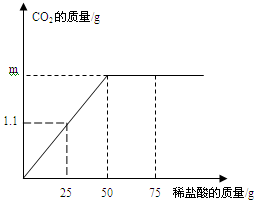
发生的化学反应方程式是:Na2CO3 + 2HCl ="=" 2NaCl + H2O + CO2↑,求:
①生成二氧化碳的质量m是 g.
②该纯碱样品中Na2CO3的质量分数。(精确到0.1%)
在一烧杯中盛有60.2gBaCO3和BaCl2的粉末状混合物,向其中加入188.8g水使混合物中可溶物完全溶解,然后向其中逐滴加入溶质质量分数为10%的稀盐酸至146g时恰好反应完全,请根据题意回答问题:
(1)在滴加盐酸过程中观察到的明显实验现象是 。
(2)当盐酸滴加至140g时,烧杯中溶液里含有溶质的是 。(写化学式)
(3)计算恰好反应完全时烧杯中所得不饱和溶液的质量。(结果精确到0.1g)
酸和碱发生中和反应,它在日常生活和农业生产中有着广泛的应用。小强同学在做中和反应实验时,向盛有40克10%氢氧化钠溶液的烧杯中逐滴加入稀硫酸,滴加过程如图所示,求所加稀硫酸的溶质质量分数。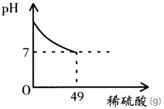
鸡蛋壳的主要成分是碳酸钙(其它成分不溶于水也不与酸反应)。化学兴趣小组为了测定鸡蛋壳中碳酸钙的含量,做如下实验: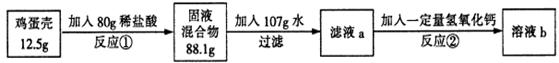
反应①结束后,所加盐酸刚好反应了一半,反应②恰好完全反应。请回答下列问题(可以选下列任意两个问题回答,并写出计算过程):
(1)反应①产生的CO2的质量为___________________;
(2)该鸡蛋壳中碳酸钙的质量分数为________________;
(3)所加氢氧化钙的质量为__________________;
(4)溶液b中溶质的质量分数为_________________;
计算过程:
将氯化钠和碳酸钠组成的固体混合物18.9克完全溶解于196.8克水中,向该溶液中 加入一定质量的氯化钡溶液恰好完全反应,滤出19.7克沉淀。若将滤液蒸发100克水后,所得溶液溶质质量分数为10%。
计算:(1)蒸发水后所得溶液的质量。
(2)所用氯化钡溶液中溶质的质量分数。
农业生产上常用溶质质量分数为16%的氯化钠溶液来选种。
(1)要配制200Kg16%的氯化钠溶液,需氯化钠的质量为 Kg和水的质量为 Kg。
(2)选种进行一段时间后,农技员估计溶液和溶质质量分数都有所减少,他取出50g氯化钠溶液,加入过量AgNO3溶液,得到沉淀14.35g。请你计算:
①AgNO3中银、氮、氧元素的质量比为 。
②氯化钠溶液中溶质的质量分数。(最后计算准确到0.1%)
(反应原理:AgNO3+NaCl=AgCl↓+NaNO3)
利用沉淀法可测定某粗盐样品的纯度(假定粗盐中的杂质全部是MgCl2)。每次取1000g样品配制成溶液,向其中加入10%的氢氧化钠溶液,测得生成沉淀的质量与所加氢氧化钠溶液的质量关系如下表所示:
| 测定次数 |
第一次 |
第二次 |
第三次 |
第四次 |
| 样品质量(g) |
1000 |
1000 |
1000 |
1000 |
| 氢氧化钠溶液质量(g) |
320 |
640 |
820 |
900 |
| 沉淀质量(g) |
23.2 |
46.4 |
58 |
58 |
(1)求粗盐的纯度(写出解题过程)。
(2)当样品与所加氢氧化钠溶液恰好完全反应时溶液中氯化钠的质量为多少?
实验室用大理石与稀盐酸反应制取CO2,反应后所得溶液体积为40mL.(假设大理石中的杂质不与盐酸反应,反应前后溶液体积不变).向该溶液中匀速逐滴加人Na2CO3溶液 并不断搅拌,测得溶液的pH随时间变化如图所示,该过程 共放出气体660mL(密度为2.0g/L)析出沉淀5.0g.
(1)根据图象可以看出.Na2CO3首先与溶液中的 反应.
(2)本实验制取CO2所用大理石中含CaCO3 g.
(3)已知制取CO2所用稀盐酸的密度为1.06g/Cm3求这种盐酸的质量分数.(计算结果保留1位小数,无计算过程不给分)
某化学实验小组要检测黄铜(铜、锌合金)中金属铜的纯度,同学们取20g黄铜样品,向其中分三次共加入15g盐酸溶液,充分反应后测得实验结果如下:
| 实验次数 |
1 |
2 |
3 |
| 盐酸质量 |
5g |
5g |
5g |
| 氢气质量 |
0.04g |
m |
0.02g |
请计算:(1)第二次实验产生氢气的质量m= g。
(2)黄铜(铜、锌合金)中金属铜的纯度。
某校课外兴趣小组对一批粗锌样品(含有杂质,杂质不溶于水,也不与酸反应)进行分析,甲、乙、丙三组同学分别进行实验,实验数据记录如下:
| 组别 药品 |
甲 |
乙 |
丙 |
| 烧杯 + 稀硫酸/g |
152.5 |
152.5 |
252.5 |
| 粗锌样品/g |
20 |
15 |
15 |
| 烧杯及剩余物/g |
172.1 |
167.1 |
267.1 |
请你认真分析数据,帮助他们回答下列问题(每组反应均充分):
(1) 组同学所取用的稀硫酸与粗锌样品恰好完全反应;
(2)计算粗锌样品中锌的质量分数;
(3)计算原硫酸溶液中溶质的质量分数;
(4)计算恰好完全反应的那组实验所得溶液中溶质的质量分数(烧杯质量为52.5g,计算结果精确到0.1%)
某纯碱样品中混有少量的氯化钠,为了测定样品的纯度,小明做了如下实验:准确称取样品11.2g,向其中加入93.2 g稀盐酸,恰好完全反应,共产生气体4.4g,请回答下列问题:(结果精确到0.1%)
(1)纯碱样品中的Na2CO3的质量分数是多少?
(2)反应后所得溶液中溶质的质量分数是多少?
(6分)实验室有一氯化钠和氯化钙组成的样品。为测定其中氯化钠的纯度并配制成一定溶质质量分数的溶液,某化学探究小组取一定质量的该样品进行如下实验。
请回答下列问题: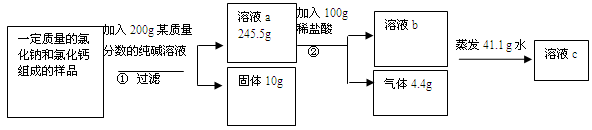
(1)写出反应②的化学方程式 ;
(2)根据已知条件列出求解①中参加反应的纯碱质量(X)的比例式
(3)该样品中氯化钠的质量分数为 ;
(4)若用36.5%的浓盐酸配制上述恰好完全反应的稀盐酸,需加水的体积为 mL;
(5)若最终所得的c溶液为只含一种溶质的不饱和溶液,则c溶液中溶质的质量分数为 ;
(6)若工业上用58.5t上述含氯化钠的样品为原料来制取氢氧化钠,可制得氢氧化钠的质量为 。
称取NaOH 和 Ba(OH)2 的固体混合物21.3g,加入100g蒸馏水,完全溶解后向该混合溶液中逐滴加入质量分数为10%的Na2SO4溶液,反应生成BaSO4沉淀的质量与所加入的Na2SO4溶液的质量关系如下图所示。试回答下列问题: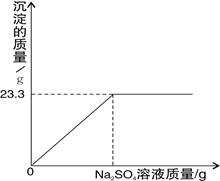
(1)完全反应后生成BaSO4沉淀 g。
(2)恰好完全反应时消耗Na2SO4溶液的质量是多少克?
(3)恰好完全反应时所得溶液中溶质的质量分数是多少?
(精确到0.1%)
(一)实验室有一瓶标签如图所示的浓盐酸,要配制200g7.3%的盐酸,需要用该盐酸多少毫升?
(二)某校化学兴趣小组用所配制的稀盐酸,测定该某矿山上的石灰石样品中碳酸钙的质量分数,假设矿石中只含杂质二氧化硅(二氧化硅是一种极难溶于水也不与盐酸反应且耐高温的固体),他们取一块,将其粉碎后,称出11g放入烧杯内(烧杯的质量为20g), 然后加入100g所配制的稀盐酸,用玻璃棒搅拌至不再产生气泡为止,二者恰好完全反应,得到下列数据,请分析表格中的数据,回答下列问题。
| |
反应前 |
反应后 |
|
| 实验 数据 |
烧杯和石灰石质量 |
加入盐酸质量 |
反应后混合物质量 |
| 31g |
100g |
126.6g |
(1)生成二氧化碳的质量为多少?
(2)此石灰石样品碳酸钙的质量分数为多少;
(3)将反应后混合物过滤,将滤液蒸发掉多少克水后可得到某温度下氯化钙的饱和溶液(某温度下,氯化钙的溶解度为25克)(计算结果保留一位小数)
(4)若某石灰厂在矿山上开采出这样的矿石550吨,最后可得含杂质的生石灰多少吨?
试题篮
()