同学们利用如图所示的装置,对质量守恒定律进行了探究。实验结束后,老师另外提出了几个问题,请你一起参与思考。
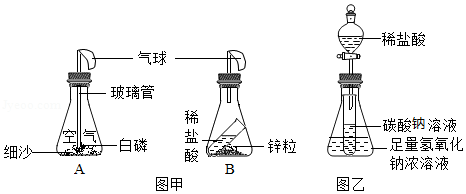
(1)图甲装置内物质充分反应后,冷却至室温,气球仍胀大的是 (选填“A”、“B”或“A和B”)
(2)若图乙装置内Na2CO3溶液的质量为5克,滴入试管的稀盐酸质量也是5克,装置内物质充分反应后,发现NaOH浓溶液质量增加0.22克,试管中滴入紫色石蕊试液变红。根据上述已知条件,通过分析可以确定的是 (选填序号)
①原稀盐酸的溶质质量分数 ②原Na2CO3溶液的溶质质量分数
③原NaOH溶液的溶质质量分数 ④反应后试管中NaCl的溶质质量分数
请你选择所填的其中一项,通过计算确定其溶质质量分数是多少?
资料显示,将新制的溶质质量分数为5%的H 2O 2溶液,加热到80℃时,才有较多氧气产生,而相同质量5%的H 2O 2溶液加入催化剂,常温下就会立即产生氧气,反应速度快,所需时间短。
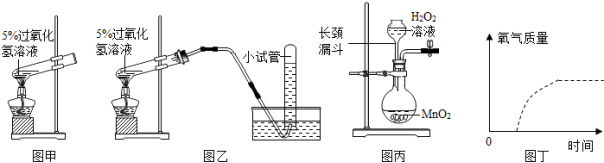
(1)小晨按图甲装置进行实验,当试管中有大量气泡出现时,伸入带火星的木条,木条并未复燃,为此,他利用图乙装置收集气体,再用带火星的木条检验,木条复燃,那么图甲实验中带火星木条未复燃的原因是 。
(2)小柯利用催化剂使H 2O 2溶液分解制取氧气,图丙是他设计的气体发生装置,请你指出一处错误 。
(3)采用相同质量5%的H 2O 2溶液,图丁虚线表示加热分解制取氧气的曲线,请你在该图中用实线画出利用催化剂制取氧气的大致曲线。 (假定两种方法H 2O 2均完全分解:曲线画在答题纸上)。
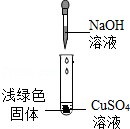
兴趣小组实验中,将NaOH溶液滴入CuSO4溶液中,结果溶液中生成了浅绿色的固体。于是,他们对该浅绿色固体的成分进行探究。
【查阅资料】
①NaOH与CuSO4反应会生产Cu(OH)2,也会生成Cu4(OH)4SO4(碱式硫酸铜)。
②Cu(OH)2在80℃会分解生成CuO。
③Cu4(OH)4SO4不溶于水,能与酸反应,分解温度需300℃。
【猜想与假设】
猜想一:浅绿色固体为Cu(OH)2。
猜想二:浅绿色固体为 。
猜想三:浅绿色固体为Cu(OH)2和Cu4(OH)4SO4。
【获取事实与证据】
①取少量浅绿色固体放入试管中,加热至100℃,观察到黑色固体物质,说明浅绿色固体中存在 。
②另取少量浅绿色固体放入试管中,加入足量稀硝酸,再滴加Ba(NO3)2溶液,出现白色沉淀,该白色沉淀是 。
【结论】整个实验证明猜想 正确。
进行氧气制取与性质检验的实验。
(1)以过氧化氢溶液为原料制取并收集氧气,应选用的装置是 (选填序号)。
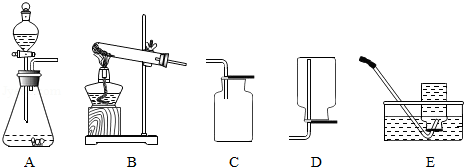
(2)实验中,用装有一定量水的集气瓶进行排水法收集氧气,能使带火星木条复燃,那么使带火星的木条复燃的氧气体积分数的最低值是多少呢?进一步展开探究。
第一组实验:5只容积均为100毫升的集气瓶,分别装入一定体积的水,再用排水法收集氧气,恰好把5只集气瓶中的水排去,将带火星的木条依次伸入5只集气瓶中,记录实验现象。
以相同方法完成第二组实验,两组实验的数据和现象见下表,(已知空气中氧气的体积分数为21%)
|
第一组 |
第二组 |
||||||||
集气瓶编号 |
A |
B |
C |
D |
E |
A |
B |
C |
D |
E |
集气前装入集气瓶内水的体积(毫升) |
10 |
20 |
30 |
40 |
50 |
31 |
33 |
35 |
37 |
39 |
带火星木条的状况 |
微亮 |
亮 |
很亮 |
复燃 |
复燃 |
很亮 |
很亮 |
复燃 |
复燃 |
复燃 |
①第一组实验D瓶,集气结束时氧气的体积分数为 %。
②经计算,第二组实验C瓶的氧气体积分数为48.65%,由此得出“使带火星的木条复燃的氧气体积分数的最低值只能是48.65%”的结论,对此结论和过程进行评价: 。
一般不用K、Ca、Na等活泼金属来置换盐溶液中的其他金属元素,这是教科书上的一句话。小科对此进行了思考,并查阅资料,对金属钠和硫酸铜溶液的反应进行探究。
【查阅资料】钠常温下就能与水发生剧烈反应,反应方程式为:2Na+2H2O═2NaOH+H2↑
【提出猜想】猜想一:金属钠和硫酸铜溶液反应会有铜生成。
猜想二:金属钠和硫酸铜溶液反应,生成的沉淀只有氢氧化铜。
【实验及现象】切取不同大小的钠块分别投入到两种不同浓度的硫酸铜溶液中,有关产生沉淀的现象如表所示
实验编号 |
钠块大小 |
硫酸铜溶液 |
实验中产生沉淀的现象 |
① |
绿豆大小 |
稀溶液10mL |
产生蓝绿色沉淀 |
② |
绿豆大小 |
浓溶液10mL |
产生蓝色絮状沉淀 |
③ |
豌豆大小 |
稀溶液10mL |
产生蓝色絮状沉淀 |
④ |
豌豆大小 |
浓溶液10mL |
产生蓝色絮状沉淀,并出现黑色固体 |
小科咨询老师后得知蓝绿色沉淀为碱式铜盐。
【实验结论】(1)上述实验中均未观察到 色固体生成,由此判断猜想一错误。
(2)实验①中观察到的沉淀是蓝绿色的,由此判断猜想二也错误。
【实验反思】
(1)实验中生成氢氧化铜沉淀的原理是 。
(2)由上述实验可知,导致钠和硫酸铜溶液反应的产物不同的因素有 。
(3)为了用钠置换硫酸铜中的铜元素,小科设计了如下实验方案
方案一:把钠块和无水硫酸铜直接混合,在干燥的空气中加热。
方案二:把钠块和无水硫酸铜直接混合,隔绝空气加热。
请从两个方案中选出合理的方案,并说明理由。 。
小科同学对实验中已经变质的氢氧化钠固体进行探究
【提出问题】氢氧化钠是否完全变质?
【猜想与假设】
①部分变质,固体是NaOH和Na 2CO 3的混合物;
②全部变质,固体是Na 2CO 3。
【查阅资料】
①Na 2CO 3溶液与FeCl 3溶液会发生反应,有红褐色絮状沉淀等现象出现;
②NaCl溶液和BaCl 2溶液均呈中性。
【进行实验】
| 步骤 |
实验操作 |
实验现象 |
| 1 |
取少量固体于小烧杯中,加水充分溶解 |
固体全部溶解 |
| 2 |
取少量烧杯中的溶液于试管中,加入过量的 BaCl 2溶液 |
产生白色沉淀 |
| 3 |
取 于另一试管中,再加入少量FeCl 3溶液 |
产生红褐色絮状沉淀 |
【解释与结论】
(1)请将步骤3实验操作补充完整;
(2)步骤2加入过量BaCl 2溶液的目的是 ;
(3)根据实验现象,可确定该固体是NaOH和Na 2CO 3的混合物。
【交流与评价】小科同学把步骤3中的FeCl 3溶液改成无色酚酞试液,若无色酚酞试液变红,也可以确定该固体是NaOH和Na 2CO 3的混合物。你认为是否合理?
得出结论: 。
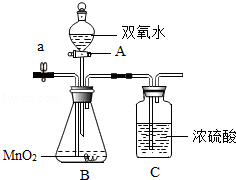
实验室新购买了一批双氧水(H2O2)溶液,某兴趣小组的同学要测定其质量分数,他们设计如图所示的装置,其实验的操作步骤如下:
①组装仪器,并检查装置的气密性;
②在A、B、C三个仪器中装入药品,其中双氧水溶液质量为50g;
③用电子秤称量出整套装置的总质量为498.6g;
④关闭a处止水夹,打开A仪器的阀门,向锥形瓶中加入全部的双氧水溶液,随即关闭A仪器的阀门;
⑤充分反应后,打开a处止水夹,向装置中持续缓慢地鼓入X气体;
⑥第二次称量整套装置的总质量为497g。
(1)本实验采用的装置中,A仪器的名称是
(2)为尽可能减小测量误差,请结合测量原理判断,操作⑤中鼓入的X气体是 。
A.氦气 B.经干燥处理的空气 C.除去氧气后的空气
(3)根据题意,计算双氧水溶液中溶质的质量分数,写出计算过程。
某混合气体可能有CO2、CO、H2中的一种或几种,某学习小组的同学为了研究气体的组成,设计了如图装置进行实验(夹持装置已省略)。实验后发现A装置中溶液变浑浊,C中的固体由黑色变红色,D中的固体有白色变蓝色,F装置中有水流入烧杯。

在反应前后对C、D装置进行了质量的测量(各步反应均完全),测量结果如表:
反应前后 |
反应前 |
反应后 |
C装置中试管与固体的总质量(克) |
a |
c |
D装置中U形管与固体的总质量(克) |
b |
d |
请分析回答下列问题:
(1)请写出A装置中反应的化学方程式 。
(2)一定能证明混合气体中有氢气存在的实验现象是
(3)F装置的作用:①“抽气”;②
(4)证明原混合气体中有CO存在的定量关系是 (用字母a、b、c、d表示。)
将光亮镁条放入一定量的稀HCl中,产生大量气泡后出现灰白色固体.某同学对该现象作如下探究.
(一)产生气泡反应的化学方程式 .
(二)过滤、洗涤、一定温度下烘干得灰白色固体.对灰白色固体作如下猜测并进行实验:
【猜测】
灰白色固体可能是:①剩余的Mg;②MgCl 2晶体;③Mg和MgCl 2晶体.
【实验】
1.取灰白色固体样品,加入稀HCl,无气泡产生,则猜测 (选填序号)不成立.
2.称取等质量的灰白色固体和MgCl 2晶体分别放入同温、等量水中,灰白色固体不溶解而MgCl 2晶体全部 ,则猜测②不成立.
查阅资料:Mg与MgCl 2饱和溶液反应可生成灰白色碱式氯化镁[Mg x(OH) yCl z],其不溶于水,能与酸反应.
3.取一定量的灰白色固体,溶于稀硝酸,将所得溶液分成两等份.
①向一份溶液中滴加过量的NaOH溶液,生成了1.160gMg(OH) 2沉淀;
②向另一份溶液中滴加过量的AgNO 3溶液,生成了1.435g沉淀;
证明AgNO 3溶液过量的方法:静置,向上层清液中滴加 溶液,无现象.
【结论】x:z= ,所得碱式氯化镁的化学式为 .
请结合图回答问题

(1)写出图1中有标号仪器的名称:a ,b .
(2)用高锰酸钾制取一瓶氧气,可选用装置A和 (选填序号)组合.装入药品前要先 ,该反应的化学方程式 .
(3)用双氧水和二氧化锰制氧气,二氧化锰的作用是 ,可选用的发生装置是 (选填序号).
(4)用如图2装置制取CO 2并验证相关性质.
①生成CO 2反应的化学方程式 .
②F装置的作用是 .
③H装置中的现象可说明CO 2具有的性质是 (答一点即可).
请根据图中所示实验装置回答问题.

(1)仪器a的名称为 ,b的名称为 .在二氧化碳、氢气两种气体中,能用C装置收集的是 ,能用D装置收集的是 ;
(2)实验室用B装置制备氧气的原理可用化学方程式表示为 .
(3)用氯酸钾和二氧化锰制备氧气时,二氧化锰在反应中的作用是 .利用下列流程分离并回收充分反应后的剩余固体,请回答下列问题.

①操作m的名称是 .操作m和操作n中都用到的玻璃仪器是 ,操作m中该仪器的作用是 .
②在分离并回收到剩余固体的过程中需要控制水的用量,原因有 (填标号).
A.握高实验效率 B.保证剩余固体全部溶解 C.节约能源
③若测得回收到的氯化钾固体质量比理论值大,原因可能是 (答一点).
请根据下列实验装置回答问题.

(1)写出仪器①和②的名称:①是 ,②是 .
(2)实验室常用B装置制取二氧化碳,发生反应的化学方程式为 ,用该发生装置可以制取氧气,反应的化学方程式为 ,收集氧气的装置为 (填字母序号)
(3)加热二氧化锰和氯酸钾的固体混合物生成氯化钾和氧气,应选用的发生装置为 (填字母序号),二氧化锰是该反应的催化剂,则二氧化锰的 和化学性质在反应前后没有发生变化,实验结束后,欲从氯化钾和二氧化锰的混合物中回收二氧化锰,需要进行溶解、 洗涤、干燥等操作.
(4)向盛有氧气的集气瓶中倒入迅速冷却的沸水,立即塞紧穿有两端开口细玻璃管的橡皮塞,用注射器向玻璃管中注水至P处,装置如图2所示.
①手拿集气瓶在水平面上摇晃数十次后,看到玻璃管中的液面将 (选填"上升"、"下降"或"不变").
②下列有关该实验的说法正确的是 .
a.可说明有少量氧气溶于水中
b.应保证装置有良好的气密性
c.用迅速冷却的沸水是因为其中几乎不含氧气.
某兴趣小组同学欲探究NaOH溶液与CO 2气体的反应,设计如图所示实验装置:
(1)若导管a与b连接,将分液漏斗中的NaOH溶液注入锥形瓶,关闭分液漏斗上的活塞,振荡,然后打开导管上的活塞,观察到的实验现象是 ,CO 2与NaOH反应的化学方程式是 ;
(2)探究反应后锥形瓶内溶液中溶质的成分:
已知Na 2CO 3+H 2O+CO 2═2NaHCO 3
NaHCO 3+NaOH═Na 2CO 3+H 2O
【提出猜想】Ⅰ.NaOH和Na 2CO 3;Ⅱ. ;
Ⅲ.NaHCO 3;Ⅳ.Na 2CO 3和NaHCO 3.
【查阅资料】①Ca(OH) 2与Na 2CO 3、NaHCO 3均能反应且有白色沉淀生成;
②CaCl 2与Na 2CO 3能反应且有白色沉淀生成,与NaHCO 3不反应;
③NaHCO 3溶液显碱性,可与酸反应生成CO 2气体.
【设计实验】限选试剂:Ca(OH) 2溶液、CaCl 2溶液、稀盐酸、酚酞试液.
| 实验操作 |
实验现象 |
实验结论 |
| 1.取少量反应后溶液于试管中,加入足量的 振荡 |
产生白色沉淀 |
猜想Ⅲ不成立 |
| 2.将操作Ⅰ所得混合物过滤,向滤液中加入足量的 ,振荡 |
|
猜想Ⅳ成立 |
【拓展应用】联想到空气中有CO 2,所以实验室中的氢氧化钠溶液应 保存.

"84"消毒液在日常生活中使用广泛,具有漂白、杀菌、消毒功效。某化学兴趣小组对一瓶敞口久置的"84"消毒液成分产生兴趣,在老师的指导下,展开探究。
【提出问题】该敞口久置的消毒液中溶质有哪些?
【查阅资料】"84"消毒液主要成分是次氯酸钠(NaClO)和氯化钠,NaClO为有效成分,有腐蚀性并易与空气中CO 2反应(2NaClO+CO 2+H 2O═2HClO+Na 2CO 3)。NaClO溶液、HClO都具有漂泊、杀菌、消毒功效。HClO不稳定,受热或光照会发生分解。
【分析讨论】小组同学经过讨论,认为该消毒液中的溶质一定有 。可能还有NaClO、Na 2CO 3、HClO中的一种或多种。
【实验过程】Ⅰ:向装入有色布条的试管中加入适量该消毒液试样,布条长时间不褪色。
Ⅱ:另取适量该消毒液试样于试管中,加入足量氯化钙溶液,静置,观察到的现象为 。
【得出结论】实验过程Ⅰ中有色布条不褪色,说明该消毒液试样中的溶质不含 。实验过程Ⅱ中反应的化学方程式为 。综上所述,该消毒液试样中的溶质为 。
【交流反思】生活中,"84"消毒液贮藏时应注意 ;一般不要"84"消毒液对蔬菜、水果进行消毒,其原因可能是 。
【拓展延伸】(1)次氯酸钠与稀硫酸可发生复分解反应,化学方程式为
(2)次氯酸钠与盐酸反应可生成有毒的氯气,日常生活中"84"消毒液不能与洁厕灵(主要成分为盐酸)混合使用。
为验证水的组成元素及探究水在电极端所发生的变化,兴趣小组用如图1所示装置(夹持仪器省略)进行实验:

Ⅰ.验证水的组成元素
步骤一:向长颈漏斗中加水(含少量Na2SO4)至充满管a和管b.关闭活塞,接通电源,一段时间后关闭电源.
步骤二:检验管中气体.
(1)Na2SO4在水中能解离出 ,增强了水的导电性;
(2)电解时观察到的现象有: ;
(3)用燃着的木条分别置于玻璃管尖嘴口,打开活塞,若观察到 ,则证明气体为H2;若观察到 ,则证明气体为O2.
(4)某同学提出实验后还需检验Na2SO4的质量是否发生变化,其原因是 .
(5)若要确定水中氢、氧元素的原子个数比,需要测定 .
Ⅱ.探究水在电极端所发生的变化
步骤一:向装置中重新加水(含少量Na2SO4)至充满管a和管b,保持活塞打开,接通电源,一段时间后关闭电源.
步骤二:分别取出管a和管b电极附近的溶液,并测定溶液的pH.
(1)测定溶液pH的方法是:用玻璃棒蘸取溶液,滴到pH试纸上,把试纸显示的颜色与 ,读取pH.经测定:管a中溶液pH小于7,管b中溶液液pH大于7.
(2)管b溶液呈 性,若向溶液中加入 ,溶液变为红色,也能得出此结论.
(3)图2中能表示电解时管a中水在电极端所发生变化的结果的是 (填对应选项的字母).
试题篮
()