叠氮化钠(NaN 3)被广泛应用于汽车安全气囊,某化学小组同学对其进行下列研究。
【査阅资料】
①NaN 3受撞击会生成Na、N 2
②NaN 3遇盐酸、H 2SO 4溶液无气体生成
③碱石灰是CaO和NaOH的混合物
④NaN 3的制备方法是:将金属钠与液态氨反应制得NaNH 2,再将NaNH 2与N 2O反应可生成NaN 3、NaOH和NH 3
【问题探究】
(1)汽车受撞击后,30毫秒内引发NaN 3迅速分解,该反应的化学方程式为 ;
(2)工业级NaN 3中常含有少量的Na 2CO 3,其原因是 (用化学方程式表示);
(3)为测定某工业级NaN 3样品中Na 2CO 3的质量分数,小组同学设计了如图实验装罝:
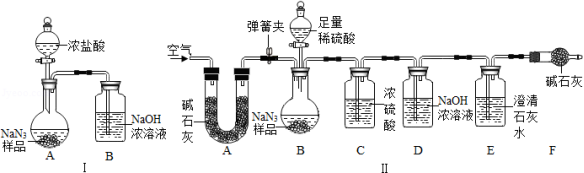
①小明同学认为通过测定装置I中反应前后B的质量差,再通过相应计算,就可测定Na 2CO 3的质量分数,小组同学通过讨论认为不可行,其理由可能是 (答出一种即可)
②小明同学在大家讨论的基础上,又设计了装罝Ⅱ,请分析:装置Ⅱ中A的作用是 。若无装置C,对测定结果造成的影响是 (填"偏大"、"偏小"或"无影响")。装置E的作用是 。
③根据装置Ⅱ,小组同学设计的实验步骤有:
a.称量装置D
b.称量样品,检査装置气密性
c.打开弹簧夹,鼓入空气
d.关闭弹簧夹,打开分液漏斗的活塞和玻璃塞,注入足量的稀琉酸,关闭活塞和玻璃塞。
其正确的顺序为 (填字母序号,可重复)
④计算碳酸钠的质量分数时,至少需要测定 个数据。(填数字)
某同学在探究硫酸化学性质时,将一定量的稀硫酸放入盛有氧化铜的试管中,观察到固体完全溶解,溶液变蓝色.反应的化学方程式是 .
同学们对于反应后溶液中的溶质成分产生了兴趣,进行了如下探究:
【猜想与假设】
猜想一:硫酸铜 猜想二: (化学式)
【活动与探究】
甲同学取少量反应后的溶液于试管中,滴加氯化钡溶液,观察到有白色沉淀产生,认为猜想一成立.
乙同学取少量反应后的溶液于试管中,加入足量的铁粉,观察到有红色固体出现,认为猜想二成立.
【反思与评价】
丙同学进过分析认为 同学的方案不合理,
理由是 .
某化学活动小组在一次实验中进行了如图1所示实验,先向A中注入一定量氯化铁溶液。再注入一定量硫酸钠溶液,此过程中观察到的现象是(1) 。小组同学对无色溶液B产生了浓厚的兴趣,进行了进一步的探究活动。
【提出问题】B中含的离子有什么?
【实验探究】
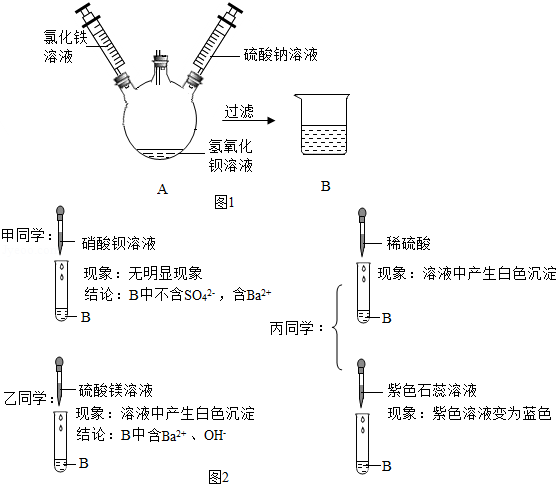
【评价交流】甲同学结论(2) (填"正确"或"错误");乙同学的探究过程不正确,理由是(3) 。
【实验结论】结合上述实验最终确定B中含有(4) (填离子符号),不含(5) (填离子符号)。
【归纳总结】由甲、乙、丙同学实验对比得出,确定溶液中可能存在的不同离子是否存在的方法是:可根据待测离子与所加试剂反应(6) 。确定出存在的离子,同时推测出与(7) 。
在探究氢氧化钙与稀盐酸中和反应实验时,忘记了滴加酚酞溶液,无法判断反应进行到何种程度,同学们决定对反应后溶液中溶质的成分进行探究.写出该化学反应的方程式 .
【提出问题】反应后溶液中的溶质是什么?
【做出猜想】猜想一:CaCl 2和Ca(OH) 2 猜想二:CaCl 2和HCl 猜想三:
请将猜想三补充完整,并说出你猜想的理由是 .
【设计方案】
| 实验操作 |
实验现象 |
实验结论 |
| ①取少量反应后的溶液于试管中,滴加酚酞试液 |
|
猜想一不正确 |
| ②另取少量反应后的溶液于试管中,加入 |
|
猜想二不正确 |
【拓展与应用】举例说明中和反应在日常生活和工农业生产中的应用 (答一点即可)
某化学兴趣小组围绕"酸和碱的中和反应"的学习,进行了如下实验。
实验一:5mL氢氧化钠溶液于烧杯中,滴入几滴酚酞溶液,可观察到现象为 ,然后加入稀盐酸,用玻璃棒搅拌,溶液褪为无色,有关的反应方程式为 。
实验二:对实验一反应后溶液中的溶质进行探究。
【提出猜想】
猜想一:只有NaCl
猜想二:有NaCl和NaOH
猜想三:有NaCl和HCl
你认为猜想 不合理,其理由是 。
【设计实验】
| 实验操作 |
实验现象 |
实验结论 |
| 取反应后的溶液于试管中,加入 |
|
猜想三成立 |
【拓展应用】我国土壤的酸碱性有"南酸北碱"之说法,你认为需向酸性土壤中加入 进行改良。
根据大量的实验总结得出酸碱盐之间相互发生复分解反应的条件是:生成物中有沉淀、气体或水。依据该条件,某化学小组的同学推断稀硫酸和氯化镁溶液不能发生复分解反应。为了进一步确认该推断的可靠性,该小组同学将一定量稀硫酸和一定量氯化镁溶液在烧杯中混合后,进行了如下探究活动。
(1)甲同学取烧杯中混合溶液分别进行以下两个实验,记录实验现象如下。请依据实验现象填写实验结论:
| 实验 |
实验现象 |
实验结论 |
| |
溶液变红 |
溶液中含有 (写离子符号) |
| |
产生白色沉淀 |
溶液中含有 (写离子符号) |
| 【甲同学的结论】稀硫酸与氯化镁溶液没有发生反应 |
||
(2)乙同学看到甲同学的实验报告后,认为甲同学的结论不正确,原因是 。为了进一步确认两者没发生反应,还需检验烧杯内的混合液中是否含有氯化镁。于是,乙同学设计了如下两个实验:
①取少量烧杯内的混合液于试管中,逐滴加入过量的 溶液,证明了混合液中含有Mg 2+.整个实验过程中乙同学观察到的实验现象是 。
②乙同学另取少量烧杯内的混合液,通过实验成功地检验出混合液中含有Cl ﹣.他设计的方案为
(写出操作和现象)。
【总结】通过上述实验,该小组同学证明了稀硫酸和氯化镁溶液确实没有发生反应。
某化学兴趣小组在做氢氧化钠溶液和稀硫酸中和反应的实验时,忘记滴加指示剂而无法判断酸碱是否恰好完全反应,于是,对反应后溶液中的溶质进行探究。
【提出问题】该溶液中的溶质是什么?
【查阅资料】Na 2SO 4溶液的pH=7
【猜想与假设】
猜想Ⅰ溶液中的溶质只有Na 2SO 4
猜想Ⅱ溶液中的溶质是Na 2SO 4和H 2SO 4
猜想Ⅲ溶液中的溶质是
【进行实验】
| 实验操作 |
实验现象 |
实验结论 |
| ①取少量反应后的溶液于 试管中,滴入酚酞溶液 |
未见变红 |
猜想Ⅲ错误 |
| ②再取少量反应后的溶液于 另一支试管中,向其中加入Na 2CO 3溶液 |
|
猜想Ⅱ正确 |
实验②中反应的化学方程式是 。
【反思拓展】若想验证猜想Ⅱ正确,在实验②中还可以用以下 代替Na 2CO 3溶液。
A.Zn B.Cu C.CuO D.BaCl 2溶液
【交流提升】在探究该中和反应的产物组成时,只需一步就可达到目的:取反应后溶液少许于试管中,滴加 溶液观察现象即可。
某化学兴趣小组获得两包制作"跳跳糖"的添加剂,一包是柠檬酸晶体,另一包是标注为钠盐的白色粉末。将少量柠檬酸和这种白色粉末溶于水,混合后产生了使澄清石灰水变浑浊的气体,为确定白色粉末的化学成分,进行了以下探究:
【提出猜想】猜想1.碳酸钠;猜想2.碳酸氢钠;猜想3.碳酸钠和碳酸氢钠。
【查阅资料】①碳酸钠溶液、碳酸氢钠溶液均呈碱性;
②碳酸氢钠受热分解生成碳酸钠、水和二氧化碳;碳酸钠受热不分解。
【实验探究1】小亮、小刚分别对有关猜想设计方案并进行实验:
| |
实验操作 |
实验现象 |
实验结论 |
| 小亮 |
将白色粉末溶于水后用pH试纸测定其酸碱度 |
pH 7(填">"、"<"或"=") |
溶液呈碱性,猜想1成立 |
| 小刚 |
用右图所示的装置进行实验 |
试管A中有水珠产生,试管B中液体变浑浊 |
猜想2成立,试管B中反应的化学方程式为 |
【实验质疑】
(1)小红认为小亮的实验结论不正确,理由是 。(用文字叙述)
(2)小明认为小刚的实验并不能得出猜想2成立,理由是 。(用文字叙述)
【实验探究2】为了进一步确定白色粉末的化学成分,小戚称取10g白色粉末与足量稀盐酸反应,充分反应后生成二氧化碳的质量为m g,通过计算并分析实验数据确定猜想3成立,则m的取谊范围为 (计算结果用分数表示)。
【结论分析】探究后他们查到该白色粉末的成分为碳酸氢钠,那么你认为白色粉末中的碳酸钠是如何产生的?写出产生碳酸钠的化学方程式 。
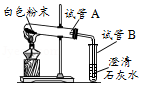
现有一瓶标签破损的白色固体(如图),化学兴趣小组的同学们决定对该白色固体成分进行实验探究。
【提出问题】这瓶白色固体的成分是什么?
【查阅资料】氯化钠,硫酸钠,硝酸钠的溶液是中性。
【做出猜想】猜想1 氯化钠 猜想2 氢氧化钠 猜想3 碳酸钠 猜想4…………
【实验探究】为了证明猜想,同学们取白色固体置于烧杯中,加水配成溶液,进行如下实验探究:
| 实验步骤 |
实验现象 |
实验结论 |
| (1)取少量溶液于试管中,滴加酚酞溶液 |
酚酞溶液变红 |
说明溶液呈 性, 猜想1不成立 |
| (2)取少量溶液于试管中,滴加稀盐酸 |
有气泡生成,气体通入澄清石灰水,石灰水变浑浊 |
猜想2 (填"成立"或"不成立") |
| (3)取少量溶液于试管中,滴加氯化钙溶液 |
试管中 |
猜想3不成立 |
【讨论交流】实验后,同学们找老师交流探讨,请教之后得出这瓶白色固体是 。
【拓展】为了进一步验证结论,同学们在老师指导下,有做了该物质受热分解的实验,确定结论正确。
聪聪做镁条在空气中燃烧实验时发现除生成白色固体外还有少量淡黄色固体,他对得到的固体成分进行探究。
【提出问题】固体成分是什么?
【提出猜想】猜想一:MgO
猜想二:Mg 3N 2
猜想三:
【查阅资料】MgO与水反应类似于CaO与水反应;Mg 3N 2与水反应产生NH 3。
| 实验操作 |
实验现象 |
实验结论 |
| 将该固体投入到盛水的烧杯中 |
若烧杯中只有白色固体,无刺激性气味气体产生 |
猜想 正确 |
|
|
猜想二或猜想三正确 |
【表达与交流】聪聪在老师的指导下,用定量的方法确定猜想三正确,请写出将固体投入水中相关反应的化学方程式。 、 。
【相关结论】空气中N 2和O 2体积比约为 ,由镁条在空气中燃烧生成少量Mg 3N 2可得出的一个结论是 。
小红同学将氢氧化钠和氢氧化钙的溶液分别加入试管A、B中,进行了如图所示的三组实验。根据实验Ⅰ、Ⅱ、Ⅲ逐步完成下列问题:

(1)小红设计的实验Ⅰ,证明酸和碱能发生中反应,写出稀盐酸和氢氧化钙溶液发生的化学方程式 。
(2)实验Ⅱ中,针对反应现象,可总结出碱溶液的化学通性之一是 。
(3)实验Ⅲ,B中有白色沉淀生成,A中无现象。为确定通入CO 2后A中溶质的成分,小红进行了如下探究:
【提出猜想】
猜想a。溶质只有氢氧化钠
猜想b。溶质只有碳酸钠
猜想c。溶质有氢氧化钠和碳酸钠
【实验与结论】
| 实验操作 |
实验现象 |
结论 |
| ①取A中溶液少量于试管中,逐滴滴加澄清石灰水 |
产生白色沉淀 |
猜想c成立 |
| ②待①中反应恰好完全时静置,取上层清液少许于试管中,滴加几滴酚酞溶液 |
溶液呈红色 |
【反思与评价】
教师评价小红得出的结论不正确,因为猜想 (选填"a"或"b")也有相同的现象。如果要验证"猜想c"成立,需将上述实验中的 换成 溶液。
小明在做"盐酸中和氢氧化钠"的实验时,实验前忘记向氢氧化钠溶液中滴加酚酞溶液,导致无法判断中和反应进行的程度,于是小明对反应后溶液的酸碱性进行了探究。
【探究目的】确定反应后溶液的酸碱性
【猜想与假设】反应后溶液呈碱性,也可能呈 ,也可能呈 。
【实验验证】
| 实验操作 |
实验现象 |
实验结论 |
| |
无色酚酞溶液 ; |
溶液呈碱性,使其呈碱性的微粒是 ; |
| 无色酚酞溶液不变色 |
溶液呈 ; |
【继续验证】
| 实验操作 |
实验现象 |
实验结论 |
| |
粉末部分或全部消失,溶液变为黄色 |
溶液呈 ,反应的化学方程式是 ; |
|
|
溶液呈 ; |
甲、乙、丙三人化学学习小组在实验中,用到了三个分别盛有NaCl溶液、NaOH溶液、Na 2SO 4溶液的滴瓶。甲同学发现乙同学将三个滴瓶中的三只滴管混用,认为乙同学实验操作不规范,滴瓶中的试剂会因此受污染而无法再次使用。学习小组就盛有NaCl溶液的滴瓶是否被另外两种试剂污染进行了如下探究。
【提出问题】该滴瓶中溶质的成分是什么?
【提出猜想】通过分析,提出如下猜想:
Ⅰ溶质成分只有:NaCl
Ⅱ溶质成分为:NaCl和NaOH
Ⅲ溶质成分为:
Ⅳ溶质成分为:NaCl、NaOH和Na 2SO 4
【实验探究】为证明猜想,甲同学设计了如下实验方案,请你一起完成下列实验报告:
| 实验操作 |
实验现象 |
结论或解释 |
| (1)取该滴瓶内溶液少量于试管中,向试管中加入适量BaCl 2溶液 |
产生白色沉淀 |
该反应的化学方程式为: |
| (2)将上述反应后的混合液过滤,向滤液中加入 |
|
猜想Ⅳ成立 |
【实验反思】丙同学认为该实验方案并未证明猜想Ⅱ、Ⅲ是否成立,应补充相应实验予以证明,你是否赞同? (填"是"或"否")。
某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验。向烧杯中的氢氧化钙溶液滴加一定量的稀盐酸后,发现忘记滴加指示剂,此时,他们停止滴加稀盐酸,并对烧杯内溶液中溶质的成分进行探究。
Ⅰ.写出该中和反应的化学方程式: 。
Ⅱ.探究烧杯内溶液中溶质成分。
【提出问题】该烧杯内溶液中的溶质是什么
【作出猜想】
猜想一:CaCl 2、Ca(OH) 2和HCl
猜想二:CaCl 2、Ca(OH) 2
猜想三:CaCl 2 、HCl
猜想四:
小明认为猜想一是不合理的,理由是 。
【查阅资料】CaCl 2溶液呈中性。
【进行实验】
(1)取少量烧杯中的溶液于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色。于是排出了猜想二,你认为排除猜想二的理由是 。
(2)小宇想用碳酸钠溶液来验证后两种猜想,请你帮他完成实验,填写以下表格。
| 实验步骤 |
现象 |
结论 |
| 取少量反应后的溶液于试管中,逐滴加入碳酸钠溶液 |
|
猜想三正确 |
|
|
猜想四正确 |
【反思交流】
为确定猜想三正确,下列几种实验方案还可行的是 ( 填字母序号 )
A.取反应后的溶液于试管中,加入镁粉冒气泡
B.取反应后的溶液于试管中,加入硝酸银溶液,生成白色沉淀
C.取反应后的溶液于试管中,滴加紫色石蕊试液变红色
D.用洁净的玻璃棒蘸取反应后的溶液,涂抹在pH试纸上,测得溶液的pH<7
已知某金属粉末由铁、铜、铝三种金属中的两种组成,兴趣小组的同学对此进行了如下探究。
【提出问题】该粉末由什么组成?
【查阅资料】铁和铜与氢氧化钠溶液都不反应,而铝与氢氧化钠溶液可反应生成溶于水的偏铝酸钠和氢气(2Al+2NaOH+2H 2O═2NaAlO 2+3H 2↑)。
【提出猜想】
猜想Ⅰ:该粉末由铜、铁组成;
猜想Ⅱ:该粉末由铜、铝组成;
猜想Ⅲ:该粉末由 组成。
【实验探究】
| 步骤 |
实验操作 |
实验现象 |
实验结论 |
| ① |
取一个烧杯,加入适量粉末样品,再加入足量的稀盐酸 |
粉末部分溶解,有气泡产生 |
粉末一定含有
|
| ② |
另取一个烧杯,加入适量粉末样品,再加入足量NaOH溶液 |
粉末部分溶解, 气泡产生 |
粉末一定含有铝 |
综合上述实验,说明猜想 成立。
【实验反思】有同学认为能用浅绿色的FeSO 4溶液代替NaOH溶液完成步骤②,你认为 (填"能"或"不能"),理由是 。
【拓展应用】铝与稀盐酸反应的化学方程式是 。
试题篮
()