阅读下列科技短文并回答问题。
过氧化氢可用于消毒杀菌,具有不稳定性。将水蒸气冷凝在硅、玻璃、塑料、金属等材料表面,均发现了过氧化氢的存在。
研究显示:水蒸气冷凝为粒径小于10微米的液滴时,部分水分子会转化为过氧化氢分子。水微滴中形成的过氧化氢含量随液滴尺寸的增大而减少。过氧化氢的产生量与湿度、温度等环境条件密切相关。当使用硅材料、相对湿度为55%时,得到过氧化氢的最大浓度随温度变化关系如图所示。

(1)文中涉及到的有机合成材料是_____。
(2)过氧化氢不稳定的原因是_____(用化学方程式表示)。
(3)下列说法错误的是_____(填字母序号)。
| A. | 水蒸气在冷凝过程中可能发生化学变化 |
| B. | 水蒸气在玻璃表面冷凝得到的液滴一定为纯净物 |
| C. | 一定条件下,水蒸气冷凝可用于材料表面的绿色消毒 |
| D. | 水蒸气冷凝为水滴时,水分子间的间隔减小 |
(4)如图中a点( )未生成过氧化氢的原因可能是_____。
阅读下列短文,并回答问题。
农药是一把“双刃剑”,在为人类带来益处的同时,有的农药也会给人类带来一些负面影响。为了趋利避害,世界上绝大多数国家都对农药实行了严格的管理,普遍建立了农药登记和淘汰退出制度,以最大限度发挥好农药对农业生产的保障作用和防范农药的使用风险。农药在投放市场前,必须申请农药登记。申请登记的农药产品,只有经农药登记部门科学评价,证明其具有预期的效果,对人畜健康或环境无不可接受的风险后,方可取得登记,并在规定的范围内销售、使用;已使用的农药,经风险监测和再评价,发现使用风险增大时,由农药登记部门作出禁用或限用规定。20世纪80年代,我国对六六六、滴滴涕等高残留有机氯农药做出了停产和停用的决定,90年代,禁止生产和使用杀虫脒、除草醚等农药。
合理使用农药,可以达到农药使用的利弊平衡,例如有科研人员测定了三唑酮在温室大棚内和室外番茄中降解规律如图1曲线。

去皮和烹饪可以去除果蔬中部分农药残留,蒸煮炒均能有效降低黄瓜中的农药残留量,但部分果蔬不适用去皮和烹饪,如橄榄、草莓、樱桃等,因此清洗成为了消费者去除农药残留的方式。由于大多数农药难溶于水,一般在水中加入食盐、面粉、NaHCO3、醋酸等用于提高农药残留的去除效果,也有人研究了利用奶粉等6种方法去除黄瓜中农药残留效果,如图2所示。
请回答下列问题:
(1)下列说法正确的是 。
A.必须全面禁止使用农药,杜绝农药对人和环境的污染
B.合理规范使用农药,既能提高作物产量又能将农药危害降低到合理范围
C.滴滴涕、除草醚已经禁止使用
(2)奶粉、洗涤盐、比亚酶、洗洁精、清水、洗菜机中除去黄瓜中农药残留效果最好的是 。
(3)温室大棚内种植番茄施用三唑酮后,番茄中残留量最大的是 天,原因是 。
钛和钛合金被认为是21世纪的重要金属材料,他们具有很多优良的性能,如熔点高,密度小,可塑性好等。以钛铁矿(主要成分为FeTiO 3,同时含有少量的Fe 2O 3、FeO等)为原料制TiO 2,再由TiO 2制金属Ti的工艺流程如图:

【查阅资料】钛、镁在高温下与空气中的氧气、二氧化碳等反应。
(1)写出工艺流程中生成硫酸铁的化学方程式 ,该反应的基本类型是 反应。
(2)操作2的名称是 。
(3)工艺流程中,水解属于 变化。
(4)工业上常在高温和氩气氛围中,用金属镁和TiCl 4反应的方法制备Ti,氩气的作用是 。
(5)TiO 2可与焦炭、氯气在高温下反应,该反应中氯气和碳的质量按71:12的比例参加反应,反应的化学方程式为 。
下列方法可以解决生活中的一些问题:
(1)在河道上设置拦污网拦截漂浮垃圾,是应用了 操作。
(2)生石灰常用作食品干燥剂,它起干燥作用时发生反应的化学方程式是 。
(3)服用含碳酸氢钠的药物可以治疗胃酸过多症,反应的化学方程式是 。
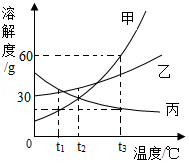
如图是甲、乙、丙三种固体物质的溶解度曲线,据图回答下列问题。
(1)0℃时,乙物质的溶解度是 。
(2)t1℃时,三种物质溶解度由大到小的顺序是 。
(3)t3℃时,将70 g甲物质加到100g水中,充分搅拌后所得溶液的质量是 g。
(4)t3℃时,将甲、丙两物质的饱和溶液同时降温至 ℃,它们溶质的质量分数相等。
10%的CaCl2溶液常用作路面的保湿剂。
(1)CaCl2中Ca、Cl元素的质量比为 ;
(2)要配制200kg 10%的CaCl2溶液,需要水的质量为 kg。
在化学反应中,凡是元素化合价发生改变的反应,称为氧化还原反应。配平这类化学方程式往往采用"化合价升降法"更方便快捷,即反应中元素"化合价升高总数=化合价降低总数"
例如:
具体配平步骤如下:
①"标变价":找出化合价发生改变的元素,并标出改变前后的化合价。
②"列变化":列出改变的价态数。
升高3价 降低4价
③"找倍数":找出化合价升、降的最小公倍数
,从而确定
、
的系数。
④"配系数":再用观察法,配平其它系数。
根据以上信息,结合已学知识,回答下列问题:
(1)
中
元素的化合价为价,
中
元素的化合价为价。
(2)请配平下列化学方程式,(系数写在方框里,所有系数必须填写)
2015年4月13日,西昌市动物疫病预防控制中心堆放在仓库中浓度为21%的过氧乙酸消毒液发生泄漏。经查阅资料可知:过氧乙酸(化学式为
)是无色液体,有强烈刺激性气味,易溶于水、乙醇等,易挥发,与其他酸有相似的化学性质,温度稍高即分解为乙酸、氧气。请回答下列问题:
(1)过氧乙酸的物理性质有:(写出两条即可)。
(2)过氧乙酸溶液中存在的阳离子是(填离子符号)。
(3)过氧乙酸中碳、氢、氧元素的质量比为:.
(4)乙酸和过氧乙酸都是无色液体,具有强烈剌激性气味,要把两种液体区别开来,可采用的方法是.
元素周期表是学习和研究化学的重要工具。请根据下表(元素周期表的部分内容)回答有关问题:
(1)写出化学符号:①硫离子 ;②三个钠原子 ;③氩气 。
(2)请从上表中查出关于硅元素的一条信息: ___________________________________。
(3)第3横行(周期)中属于金属元素的是 _____(填一种),该元素的离子与Cl—形成的化合物的化学式为 。
根据下列化合物与单质相互转化的关系,回答:
(1)若乙的溶液为浅绿色,Y是红色固体,则X是_____。
可能的化学方程式为________________________________________.
(2)若在常温下乙是气体,则X是__________。
氢氧化铯(CsOH)是一种可溶性强碱,被称为碱中之王。氢氧化铯不仅具有碱的通性,氢氧化铯溶液还能与铝、锌等金属反应生成H2。下列有关说法正确的是:
| A.CsOH可用于改良酸性土壤 |
| B.CsOH溶液不能使无色酚酞溶液变色 |
| C.CsOH与硫酸反应生成盐的化学式为CsSO4 |
| D.能与锌和铝反应生成H2的溶液不一定能使紫色石蕊溶液变红 |
阅读下面科普短文。
19世纪初,铝是比黄金还贵的金属,主要是由于铝的化学性质很活泼,在自然界以化合物形式存在。当时采用钠与氯化铝在一定条件下发生置换反应得到铝,因生产成本高,所以铝十分珍贵。
19世纪末,霍尔应用电解熔融金属化合物的方法制备金属。他在用氧化铝制备金属铝的过程中,发现氧化铝的熔点很高(2050℃),很难达到熔融状态,必须物色一种能够溶解氧化铝而又能降低其熔点的材料,实验过程中发现冰晶石(Na3AlF6)能起到这种作用。
霍尔在坩埚中,把氧化铝溶解在10%~15%的熔融的冰晶石里进行电解,发现有小球状银白色的铝生成,冰晶石在电解过程中不被分解,并有足够的流动性,有利于电解的进行。这种廉价炼铝方法的发现,使铝成为广泛应用的金属材料,至今仍在使用。
根据文章内容,回答下列问题:
(1)金属铝的物理性质 。
(2)冰晶石中氟元素的化合价为 。
(3)用金属钠制取铝的化学方程式为 。
(4)霍尔用电解法制取铝的化学方程式为 。
(5)电解法制铝的过程中,冰晶石的作用是 。
某同学把自制的一种黄色花汁,分别滴加到下列不同的试剂中,并记录观察到的现象如下表所示.
| 试剂 |
稀盐酸 |
食醋 |
蔗糖水 |
蒸馏水 |
肥皂水 |
烧碱溶液 |
石灰水 |
| 颜色 |
红 |
红 |
黄 |
黄 |
绿 |
绿 |
绿 |
请分析上表,并回答下列问题:
(1)该花汁________(填“可以”或“不可以”)作酸碱指示剂.
(2)蚊子叮咬人时注入蚁酸(具有酸的性质),使皮肤红肿、痛痒.要缓解这种症状,简单可行的办法是在叮咬处涂抹上述试剂中的________.
(3)石灰水露置于空气中易变质,写出变质反应的化学方程式:________.
近年来,食品添加剂成了国内外食品安全与健康饮食的焦点问题.据《人民日报》报道,目前我国有近90%的食品中含有合法或违法的食品添加剂.那么,如何科学地看待食品添加剂呢?
我们知道,化学是认识物质、改造物质和应用物质的科学,从化学视角看食品添加剂,主要是从其元素组成与结构,物理、化学性质及在人体内的变化等方面入手.
下表中给出了4种食品添加剂.试回答有关问题:
(1)请你在下表空白处填上物质的化学式.
| 物质名称 |
物质组成(填化学式) |
主要化学性质及在人体内变化 |
类别或作用 |
法律规定 |
| 碳酸氢钠 |
|
无毒、弱碱性、易与胃酸反应 |
膨松剂 |
可用 |
| 硫酸铜 |
|
|
增色 |
国家严禁使用 |
| 铁(还原性铁粉) |
|
比较活泼的金属,能与胃酸反应 |
抗氧化剂 |
依据国家标准,可用 |
| 甲醛 |
CH2O |
|
防腐 |
国家严禁使用 |
(2)还原性铁粉用作食品添加剂,除能够防止食品因氧化而变质外,还是一种营养强化剂,这是因为________________.
(3)碳酸氢钠是面食类食品经常使用的添加剂,如蒸馒头时人们常常加适量的碳酸氢钠.少量碳酸氢钠食入人体,不会危害人体健康.请你从碳酸氢钠的性质、在胃液中的变化,以及人体所必需的营养元素三个方面,解释为什么它不会对人体产生危害.________________________.
隔夜菜是否能吃,主要在于烧熟后的隔夜菜中亚硝酸盐的含量是否符合食品安全要求.蔬菜中的硝酸盐来自生长过程中所施氮肥.空气中的微生物(如硝酸盐还原菌)进入到蔬菜中.会产生一种还原酶,将蔬菜中的部分硝酸盐还原成亚硝酸盐.烧熟后的菜在食用和保存阶段都会有一些细菌进入;做熟的蔬菜更适合细菌生长.
某研究小组对烧熟的菜中亚硝酸盐含量做了测试,下表为盖有保鲜膜的菜肴在4℃的冰箱中放置不同时间的亚硝酸盐含量(单位:mg/kg).
| 菜肴 |
半小时 |
6小时 |
18小时 |
24小时 |
| 炒青菜 |
0.6861 |
0.7982 |
4.3333 |
5.3624 |
| 韭菜炒蛋 |
1.8153 |
1.9249 |
2.8390 |
5.6306 |
| 红烧肉 |
2.4956 |
4.2558 |
4.3668 |
5.5188 |
| 红烧鲫鱼 |
|
2.0948 |
3.2300 |
7.2397 |
将一份红烧鲫鱼样本(不盖保鲜膜)在常温下放置4小时,测定其亚硝酸盐含量为8.9483mg/kg.
请根据以上材料,回答下列问题:
(1)亚硝酸盐中含有 ,其中氮元素的化合价是________价.
,其中氮元素的化合价是________价.
(2)根据表中的数据,菜中的亚硝酸盐含量变化的共同规律是________________________________.
(3)要使烧熟后的隔夜菜中亚硝酸盐含量尽可能低,保存的条件应该是________________________.
(4)炒菜过程中温度一般在100℃以上,你认为从生菜炒到熟菜过程中的亚硝酸盐含量是否会持续增加________,原因是________________________.
试题篮
()