(5分) A、B可发生中和反应,D是生活中最常见的液体。通常情况下,F、G、I为气体,且F是一种清洁能源。X是目前应用最广泛的金属,Y常用作食品干燥剂。各物质问的转化关系如图所示(个别 产物略去)。
(1)B俗称 。
(2)F与G混合后遇明火可能发生 ,与F此性质相似的气体还有 。(写一种物质化学式)
(3)反应 ③的反应类型是 ;
(4)反应②的化学方程式为
某工厂废料中含有铜、氧化铜和碳中的一种或几种,按如下流程进行反应,请回答:
① A、C、D、E四种物质中,属于氧化物的是 (13) (填字母)。
② 蓝色溶液B中含有溶质的化学式 (14) ,产生气体E的化学方程式 (15) 。
③ 由此可以确定废料的成分是 (16) 。
现有一包白色粉末,可能由NaCl、Na2SO4、Na2CO3、CuSO4中的一种或几种组成。现做如下实验:(1)取少量粉末,加水溶解得无色溶液;(2)另取少量粉末,滴加稀盐酸,无明显现象。请回答:
①由实验(1)可确定原粉末中一定没有 ; 由实验(2)可确定原粉末中一定没有 。②为进一步确定原粉末的组成,另取少量粉末按如图所示进行实验:(每步所加试剂均不同) 
原粉末的成分是 ,写出无色溶液与X反应生成白色沉淀的化学方程式 。
柠檬酸(C6H8O7)是一种工业原料,广泛应用于食品、医药等行业。如图是两种不同方法制备一水柠檬酸晶体(C6H8O7·H2O)的工艺流程图。回答相关问题:
【资料卡片】
①柠檬酸水溶液显酸性;
②工业生产柠檬酸,原料预处理后,得到的发酵液中含有柠檬酸及其他可溶性杂质;
③一水柠檬酸在不同温度下的溶解度如下表:
| 温度/℃ |
0 |
10 |
20 |
30 |
40 |
|
| 溶解度/g |
96 |
118 |
146 |
183 |
216 |
|
④某种专用树脂对柠檬酸的吸附率和水温的关系如图:
【钙盐法制备】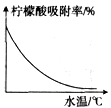
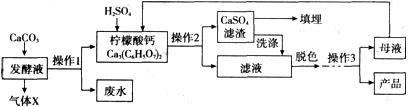
(1)气体X是____(填化学式),实验室检验该气体的化学方程式为________________;
(2)在发酵液中加入CaCO3,同时升温至90℃,这样做的目的是____________ ;
(3)加入硫酸反应的化学方程式为____,是____(填基本反应类型)反应;
(4)操作l、2的名称是____,实验室完成此操作,所需的玻璃仪器有____(填字母序号)及玻璃棒;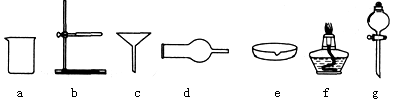
(5)操作3的目的是得到一水柠檬酸晶体,操作顺序是b→____→a;
a.过滤 b.加热浓缩 c.冷却结晶 d.蒸发结晶
(6)工业生产中,可加入____(填名称)进行脱色处理;
(7)洗涤CaSO4滤渣的目的是____;
(8)母液可以循环,其中一定含有的溶质是____;
【变温色谱分离法制备】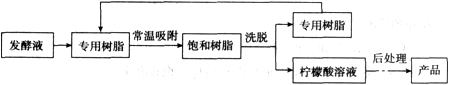
(9)洗脱的目的是使专用树脂再生,根据资料,洗脱操作适宜用____;
(10)对比“变温色谱分离法”“钙盐法”的劣势除了消耗资源,请列举破坏环境的两个方面:____、____。
(8分)二氧化碳的“捕捉”与“封存”是实现温室气体减排的重要途径之一。实际生产中,经常利用足量NaOH溶液来“捕捉”CO2,流程图如下(部分条件及物质未标出)。
①图中标出的物质中,属于碱类物质的化学式为 ;
②该流程图所标出的物质中,溶于水放出大量热的氧化物是 ,与水发生反应的化学方程式为 ;
③“捕捉室”中发生的的化学方程式为 ,整个“捕捉”过程中,可循环使用的物质是 和 。
如图所示A—G是初中化学常见的物质。图中“→”表示转化关系,“—”表示相互能反应。已知A是人体胃液中含有的酸,G是最轻的气体,B、C、D、E、F都是氧化物。请回答: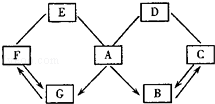
(1)G的化学式为__________。
(2)E与F发生化学反应的基本类型是__________,写出物质A的一种用途__________;
(3)A、D发生反应的化学方程式可能为_________。
现有A、B、C、D四种无色溶液,分别是稀盐酸、碳酸钠溶液、石灰水、氢氧化钠溶液中的一种,为了鉴别它们进行如下实验:①取四种溶液分别滴加酚酞视野,只有A中无色其它均为红色;②将A滴入余下的三种溶液中,只有B中出现气泡.
(1)A物质是 _________ ;
(2)A与B反应出现气泡的化学方程式是 _________ ;
(3)用B物质可将余下的两种溶液鉴别开,则鉴别时反应的化学方程式为 _________ .
(7分)下图表示某些物质间转化关系。A、D为固体且组成元素相同,A为紫黑色;X、F为液体且组成元素相同,E为产生温室效应的常见气体,Y是红色的金属。请回答: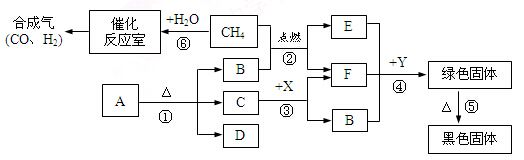
(1)写出化学式:B ,Y ;
(2)C在反应③中起 作用。
(3)写出有关反应的化学方程式:① ;⑤ 。
(4)反应⑥在催化反应室中进行,且发生多个反应,如Ⅰ和Ⅱ,请推断完成反应Ⅱ的化学方程式:
Ⅰ 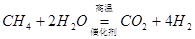 Ⅱ C+
Ⅱ C+ 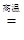 2CO
2CO
(5)若将合成气中两气体按分子数之比为1:1进行化合(原子利用率为100%),可合成多种有机化工产品,写出其中一种可能产品的化学式 。
(5分)下图中的A~G是初中化学常见的纯净物,且均含有一种相同的元素。其中A的饱和溶液加热后会变浑浊,B、C是氧化物;E是发酵粉的主要成分,E、G分别与足量F反应的生成物相同。图中“一”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;部分反应物或生成物已略去。
(1)写出C的化学式
(2)在B和C的混合物中滴加无色酚酞溶液,酚酞溶液显
(3)写出F和D反应的化学方程式
(4)写出G的一种用途
已知A、B、C、D、E为初中化学中常见的五种不同类别的物质,其中A为年产量最高的金属单质,各种物质间的反应和转化关系如图所示(“——”表示相连的两种物质之间可以发生反应,“―→”表示一种物质可以转化为另一种物质;反应条件、部分反应物和生成物已略去)。请写出:
(1)B的化学式:_____________________;
(2)D与E反应的化学方程式:_ __。
硅钢可用于制造变压器的铁芯,某化学兴趣小组的同学为了验证硅钢(主要含有
、
、
),设计了如图的试验流程(有些反应的部分反应物和生成物已省略).查阅资料发现常温下,单质硅(
)不能与盐酸反应,但能与氢氧化钠溶液反应(
).
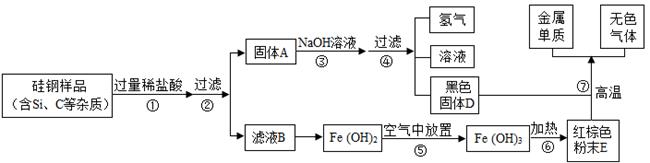
根据以上信息,回答下列问题:
(1)固体A的成分为,滤液B中的金属阳离子为;
(2)写出步骤⑦中发生反应的化学方程式;其基本反应类型为;
(3)在过滤操作时,若发现滤液浑浊,应;
(4)步骤⑤中发生的是化合反应,尝试写出其化学方程式.
A-J是初中化学常见的物质,它们之间的转化如图1所示("-"表示相邻的两物质可以发生反应,"→"表示箭头前面的物质可以转化为箭头后面的物质;部分反应的反应物、生成物和反应条件没有标出)。图2所示的是部分物质的相关信息;I、J中含有相同的金属元素,H的相对分子质量比E的大。
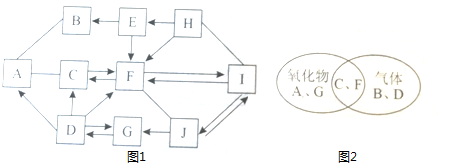
(1)F的化学式是。
(2)物质I俗称。
(3)写出上述物质转化过程中属于分解反应的一个化学方程式。
(4)写出H→E的化学方程式。
为了验证黄铜样品(Cu、Zn合金)中,铜的质量分数,小浩同学做了如下试验,往93.7g一定质量分数的稀硫酸溶液中,加入10g样品,并按时称量剩余固体的质量如下表:
| 反应时间(min) |
1 |
2 |
3 |
4 |
5 |
| 剩余固体质量 (g) |
6.75 |
5 |
4 |
3.5 |
3.5 |
(1)合金中铜的质量分数是 ;
(2)反应后溶液中溶质质量分数是多少?
(3)往溶液中加入合金样品时,剩余固体的质量为什么开始减少较快,而后逐渐减少较慢。
下列是初中化学常见物质间的转化关系,这些物质由碳、氢、氧元素组成的,其中,甲、乙为单质,A、B、C、D为化合物,且A与B的组成元素相同,C与D的组成元素也相同,其余反应条件、部分反应物已略去,试推断:
(1)转化①的化学方程式为 ;
(2)转化①转化②均属于 (填基本反应类型);
(3)选择图中物质实现转化③,则物质C的化学式为 ;
(5分)一包白色粉末,由硫酸铜、碳酸钙、氯化钡、硫酸钠、氢氧化钠中的两种或两种以上的物质混合而成。为探究其组成,进行如下实验:
(1)取少量白色粉末,向其中加入足量的水,充分搅拌后过滤,得到白色沉淀和无色滤液。则原白色粉末中一定不含有_____________。
(2)取实验(1)滤出的白色沉淀,向其中加入足量的盐酸,沉淀全部溶解,并产生无色气体。则原白色粉末中一定含有____________________。
根据上述实验可推断:原白色粉末的组成有____________种可能。
为进一步探究原白色粉末的组成,取实验(1)得到的滤液,向其中通入CO2,产生白色沉淀,则可推断原白色粉末中一定还含有________________。
试题篮
()