a、b、c、d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b原子次外层的电子数相同;c所在周期数与族数相同;d与a同族。下列叙述正确的是( )
| A. |
原子半径:d>c>b>a |
B. |
4种元素中b的金属性最强 |
| C. |
c的氧化物的水化物是强碱 |
D. |
d单质的氧化性比a单质的氧化性强 |
今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是( )
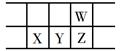
| A. |
原子半径:W<X |
B. |
常温常压下,Y单质为固态 |
| C. |
气态氢化物热稳定性:Z<W |
D. |
X的最高价氧化物的水化物是强碱 |
W、X、Y、Z均为短周期元素且原子序数依次增大,元素X和Z同族。盐YZW与浓盐酸反应,有黄绿色气体产生,此气体同冷烧碱溶液作用,可得到YZW的溶液。下列说法正确的是( )
| A. |
原子半径大小为W<X<Y<Z |
B. |
X的氢化物水溶液酸性强于Z的 |
| C. |
Y 2W 2与ZW 2均含有非极性共价键 |
D. |
标准状况下W的单质状态与X的相同 |
砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等.回答下列问题:
(1)写出基态As原子的核外电子排布式________.
(2)根据元素周期律,原子半径Ga________As,第一电离能Ga________As.(填"大于"或"小于")
(3) 分子的立体构型为________,其中As的杂化轨道类型为________.
(4) 的熔点高于1000℃, 的熔点为77.9℃,其原因是________.
(5)GaAs的熔点为1238℃,密度为 , 其晶胞结构如图所示.
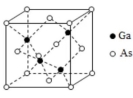
该晶体的类型为________,Ga与As以________键键合.Ga和As的摩尔质量分别为 和 , 原子半径分别为 和 ,阿伏伽德罗常数值为 ,则GaAs晶胞中原子的体积占晶胞体积的百分率为________.
短周期元素 的原子序数依次增加。 是由这些元素组成的二元化合物, 是元素 的单质,通常为黄绿色气体, 的水溶液具有漂白性, 溶液的 为 2, 通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是( )
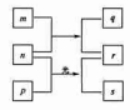
| A. |
原子半径的大小 |
| B. |
元素的非金属性 |
| C. |
Y 的氢化物常温常压下为液态 |
| D. |
的最高价氧化物的水化物为强酸 |
我国嫦娥五号探测器带回1.731kg的月球土壤,经分析发现其构成与地球土壤类似。土壤中含有的短周期元素W、X、Y、Z,原子序数依次增大,最外层电子数之和为15。X、Y、Z为同周期相邻元素,且均不与W同族。下列结论正确的是( )
| A. |
原子半径大小顺序为 |
| B. |
化合物XW中的化学键为离子键 |
| C. |
Y单质的导电性能弱于Z单质的 |
| D. |
Z的氧化物的水化物的酸性强于碳酸 |
W、X、Y、Z为原子序数依次增大的短周期主族元素,Z的最外层电子数是W和X的最外层电子数之和,也是Y的最外层电子数的2倍。W和X的单质常温下均为气体。下列叙述正确的是( )
| A. |
原子半径: |
| B. |
W与X只能形成一种化合物 |
| C. |
Y的氧化物为碱性氧化物,不与强碱反应 |
| D. |
W、X和Z可形成既含有离子键又含有共价键的化合物 |
短周期主族元素X、Y、Z、W的原子序数依次增大,基态X原子的电子总数是其最高能级电子数的2倍,Z可与X形成淡黄色化合物Z2X2,Y、W最外层电子数相同。下列说法正确的是( )
A.第一电离能:W>X>Y>Z
B.简单离子的还原性:Y>X>W
C.简单离子的半径:W>X>Y>Z
D.氢化物水溶液的酸性:Y>W
氨硼烷(NH 3BH 3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
(1)H、B、N中,原子半径最大的是 。根据对角线规则,B的一些化学性质与元素 的相似。
(2)NH 3BH 3分子中,N﹣B化学键称为 键,其电子对由 提供。氨硼烷在催化剂作用下水解释放氢气:
3NH 3BH 3+6H 2O═3NH 4 ++B 3O 6 3 ﹣+9H 2
B 3O 6 3 ﹣的结构为 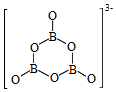 .在该反应中,B原子的杂化轨道类型由 变为 。
.在该反应中,B原子的杂化轨道类型由 变为 。
(3)NH 3BH 3分子中,与N原子相连的H呈正电性(H δ +),与B原子相连的H呈负电性(H δ﹣),电负性大小顺序是 。与NH 3BH 3原子总数相等的等电子体是 (写分子式),其熔点比NH 3BH 3 (填"高"或"低"),原因是在NH 3BH 3分子之间,存在 作用,也称"双氢键"。
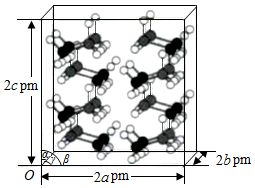
(4)研究发现,氨硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为apm、bpm、cpm,α=β=γ=90°.氨硼烷的2×2×2超晶胞结构如图所示。氨硼烷晶体的密度ρ= g•cm ﹣ 3(列出计算式,设N A为阿伏加德罗常数的值)。
W、X、Y、Z为原子序数依次增大的短周期元素,四种元素的核外电子总数满足X+Y=W+Z;化合物XW3
与WZ相遇会产生白烟。下列叙述正确的是( )
A.非金属性:W>X>Y>Z
B.原子半径:Z>Y>X>W
C.元素X的含氧酸均为强酸
D.Y的氧化物水化物为强碱
1934年约里奥﹣居里夫妇在核反应中用α粒子(即氦核 He)轰击金属原子 X,得到核素 Y,开创了人造放射性核素的先河: X He→ Y n其中元素X、Y的最外层电子数之和为8.下列叙述正确的是( )
A. X的相对原子质量为26
B.X、Y均可形成三氯化物
C.X的原子半径小于Y的
D.Y仅有一种含氧酸
试题篮
()