水泥是重要的建筑材料。水泥熟料的主要成分为 、 ,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
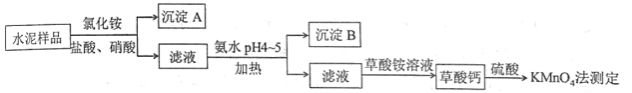
回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是__________,还可使用___________代替硝酸。
(2)沉淀A的主要成分是_________________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为____________________________________。
(3)加氨水过程中加热的目的是___________。沉淀B的主要成分为_____________、____________(写化学式)。
(4)草酸钙沉淀经稀 处理后,用 标准溶液滴定,通过测定草酸的量可间接获知钙的含 量,滴定反应为: 。实验中称取 水泥样品,滴定时消耗了 的 溶液 ,则该水泥样品中钙的质量分数为______________。
由下列实验及现象不能推出相应结论的是( )
|
实验 |
现象 |
结论 |
|
|
A. |
向 的 溶液中加足量铁粉,振荡,加1滴KSCN溶液 |
黄色逐渐消失,加KSCN溶液颜色不变 |
还原性: |
|
B. |
将金属钠在燃烧匙中点燃,迅速伸入集满 的集气瓶 |
集气瓶中产生大量白烟,瓶内有黑色颗粒产生 |
具有氧化性 |
|
C. |
加热盛有少量 固体的试管,并在试管口放置湿润的红色石蕊试纸 |
石蕊试纸变蓝 |
显碱性 |
|
D. |
向2支盛有 相同浓度银氨溶液的试管中分别加入2滴相同浓度的 和 溶液 |
一只试管中产生黄色沉淀,另一支中无明显现象 |
|
高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
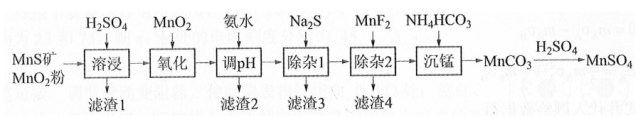
相关金属离子[ ]形成氢氧化物沉淀的pH范围如下:
|
金属离子 |
|
|
|
|
|
|
|
|
开始沉淀的pH |
8.1 |
6.3 |
1.5 |
3.4 |
8.9 |
6.2 |
6.9 |
|
沉淀完全的pH |
10.1 |
8.3 |
2.8 |
4.7 |
10.9 |
8.2 |
8.9 |
(1)"滤渣1"含有S和________;写出"溶浸"中二氧化锰与硫化锰反应的化学方程式________。
(2)"氧化"中添加适量的 的作用是将________。
(3)"调pH"除铁和铝,溶液的pH范围应调节为________~6之间。
(4)"除杂1"的目的是除去 和 , "滤渣3"的主要成分是________。
(5)"除杂2"的目的是生成 沉淀除去 。若溶液酸度过高, 沉淀不完全,原因是________。
(6)写出"沉锰"的离子方程式________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为 , 其中Ni、Co、Mn的化合价分别为+2、+3、+4。当 时, z=________。
碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题:
(1) 的一种制备方法如下图所示:
①加入 粉进行转化反应的离子方程式为_________,生成的沉淀与硝酸反应,生成________后可循环使用。
②通入 的过程中,若氧化产物只有一种,反应的化学方程式为__________;若反应物用量比 时,氧化产物为_________;当 ,单质碘的收率会降低,原因是___________。
(2)以 为原料制备 的方法是:先向 溶液中加入计量的 ,生成碘化物;再向混合溶液中加入 溶液,反应得到 ,上述制备 的总反应的离子方程式为__________。
(3) 溶液和 溶液混合可生成 沉淀和 ,若生成 ,消耗的 至少为_______ 。 在 溶液中可发生反应: 。实验室中使用过量的 与 溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量 的原因是________。
钒具有广泛用途。黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO 2、Fe 3O 4。采用如图工艺流程可由黏土钒矿制备NH 4VO 3。
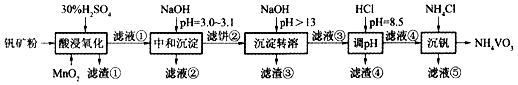
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示。
|
金属离子 |
Fe 3+ |
Fe 2+ |
Al 3+ |
Mn 2+ |
|
开始沉淀pH |
1.9 |
7.0 |
3.0 |
8.1 |
|
完全沉淀pH |
3.2 |
9.0 |
4.7 |
10.1 |
回答下列问题:
(1)"酸浸氧化"需要加热,其原因是 。
(2)"酸浸氧化"中,VO +和VO 2+被氧化成VO 2 +,同时还有 离子被氧化。写出VO +转化为VO 2 +反应的离子方程式 。
(3)"中和沉淀"中,钒水解并沉淀为V 2O 5•xH 2O,随滤液②可除去金属离子K +、Mg 2+、Na +、 ,以及部分的 。
(4)"沉淀转溶"中,V 2O 5•xH 2O转化为钒酸盐溶解。滤渣③的主要成分是 。
(5)"调pH"中有沉淀生产,生成沉淀反应的化学方程式是 。
试题篮
()