过氧化钙微溶于水,溶于酸,可用作分析试剂、医用防腐剂、消毒剂.以下是一种制备过氧化钙的实验方法.回答下列问题:
(一)碳酸钙的制备

(1)步骤①加入氨水的目的是________.小火煮沸的作用是使沉淀颗粒长大,有利于________.
(2)如图是某学生的过滤操作示意图,其操作不规范的是________(填标号).

| A. |
漏斗末端颈尖未紧靠烧杯壁 |
| B. |
玻璃棒用作引流 |
| C. |
将滤纸湿润,使其紧贴漏斗壁 |
| D. |
滤纸边缘高出漏斗 |
| E. |
用玻璃棒在漏斗中轻轻搅动以加过过滤速度 |
(3)(二)过氧化钙的制备
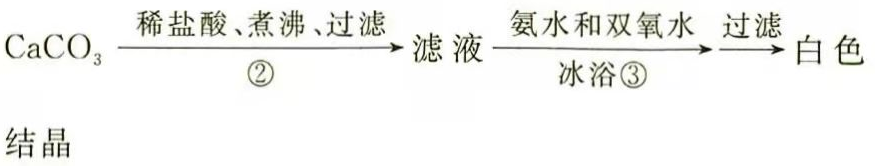
步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈________性(填"酸"、"碱"或"中").将溶液煮沸,趁热过滤,将溶液煮沸的作用是________.
(4)步骤③中反应的化学方程式为________,该反应需要在冰浴下进行,原因是________.
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是________.
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品.该工艺方法的优点是________,产品的缺点是________.
胆矾( )易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到的 (杂质为氧化铁及泥沙)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题:
(1)制备胆矾时,用到的实验仪器除量筒、酒精灯、玻璃棒、漏斗外,还必须使用的仪器有________(填标号)。
| A. |
烧杯 |
B. |
容量瓶 |
C. |
蒸发皿 |
D. |
移液管 |
(2)将 加入到适量的稀硫酸中,加热,其主要反应的化学方程式为___________,与直接用废铜和浓硫酸反应相比,该方法的优点是_________。
(3)待 完全反应后停止加热,边搅拌边加入适量 ,冷却后用 调 为3.5~4,再煮沸 ,冷却后过滤。滤液经如下实验操作:加热蒸发、冷却结晶、________、乙醇洗涤、________,得到胆矾。其中,控制溶液 为3.5~4的目的是_________,煮沸 的作用是_________。
(4)结晶水测定:称量干燥坩埚的质量为 ,加入胆矾后总质量为 ,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为 。根据实验数据,胆矾分子中结晶水的个数为_________(写表达式)。
(5)下列操作中,会导致结晶水数目测定值偏高的是________(填标号)。
| A. |
①胆矾未充分干燥 |
| B. |
②坩埚未置于干燥器中冷却 |
| C. |
③加热时有少胆矾迸溅出来 |
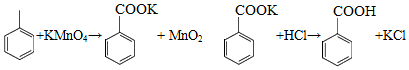
苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下:
|
名称 |
相对分子质量 |
熔点/℃ |
沸点/℃ |
密度/(g•mL﹣1) |
溶解性 |
|
甲苯 |
92 |
﹣95 |
110.6 |
0.867 |
不溶于水,易溶于乙醇 |
|
苯甲酸 |
122 |
122.4(100℃左右开始升华) |
248 |
﹣﹣ |
微溶于冷水,易溶于乙醇、热水 |
实验步骤:
(1)在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5mL甲苯、100mL水和4.8g (约0.03mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。
(2)停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0g。
(3)纯度测定:称取0.122g粗产品,配成乙醇溶液,于100mL容量瓶中定容。每次移取25.00mL溶液,用0.01000mol•L﹣1的KOH标准溶液滴定,三次滴定平均消耗21.50mL的KOH标准溶液。
回答下列问题:
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为 (填标号)。
A.100mL B.250mL C.500mL D.1000mL
(2)在反应装置中应选用 冷凝管(填“直形”或“球形”),当回流液不再出现油珠即可判断反应已完成,其判断理由是 。
(3)加入适量饱和亚硫酸氢钠溶液的目的是 ;该步骤亦可用草酸在酸性条件下处理,请用反应的离子方程式表达其原理 。
(4)“用少量热水洗涤滤渣”一步中滤渣的主要成分是 。
(5)干燥苯甲酸晶体时,若温度过高,可能出现的结果是 。
(6)本实验制备的苯甲酸的纯度为 ; 据此估算本实验中苯甲酸的产率最接近于 (填标号)。
A.70% B.60% C.50% D.40%
(7)若要得到纯度更高的苯甲酸,可通过在水中 的方法提纯。
试题篮
()