水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与 碱性悬浊液(含有 )混合,反应生成 ,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化, 被 还原为 ,在暗处静置 ,然后用标准 溶液滴定生成的 ( )。
回答下列问题:
(1)取水样时应尽量避免扰动水体表面,这样操作的主要目的是_____________。
(2)"氧的固定"中发生反应的化学方程式为_______________。
(3) 溶液不稳定,使用前需标定。配制该溶液时需要的玻璃仪器有烧杯、玻璃棒、试剂瓶和____________;蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除____及二氧化碳。
(4)取 水样经固氧、酸化后,用 溶液滴定,以淀粉溶液作指示剂,终点现象为________________;若消耗 溶液的体积为 ,则水样中溶解氧的含量为_________mg·L − 1。
(5)上述滴定完成时,若滴定管尖嘴处留有气泡会导致测量结果偏___________。(填"高"或"低")
水泥是重要的建筑材料。水泥熟料的主要成分为 、 ,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
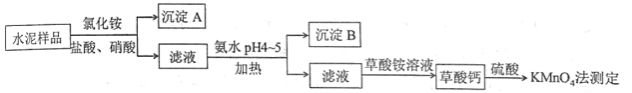
回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是__________,还可使用___________代替硝酸。
(2)沉淀A的主要成分是_________________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为____________________________________。
(3)加氨水过程中加热的目的是___________。沉淀B的主要成分为_____________、____________(写化学式)。
(4)草酸钙沉淀经稀 处理后,用 标准溶液滴定,通过测定草酸的量可间接获知钙的含 量,滴定反应为: 。实验中称取 水泥样品,滴定时消耗了 的 溶液 ,则该水泥样品中钙的质量分数为______________。
下列实验操作规范且能达到目的的是( )
|
目的 |
操作 |
|
|
A. |
取 盐酸 |
在 酸式滴定管中装入盐酸,调整初始读数为 后,将剩余盐酸放入锥形瓶 |
|
B. |
清洗碘升华实验所用试管 |
先用酒精清洗,再用水清洗 |
|
C. |
测定醋酸钠溶液 |
用玻璃棒蘸取溶液,点在湿润的 试纸上 |
|
D. |
配制浓度为 的 溶液 |
称取 固体 ,放 容量瓶中,加水溶解并稀释至刻度 |
立德粉
(也称锌钡白),是一种常用白色颜料。回答下列问题:
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品时,钡的焰色为__________(填标号)。
| A. |
黄色 |
| B. |
红色 |
| C. |
紫色 |
| D. |
绿色 |
(2)以重晶石( )为原料,可按如下工艺生产立德粉:
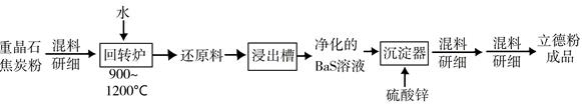
①在回转窑中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为________。回转窑尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为 和一种清洁能源气体,该反应的化学方程式为________。
②在潮湿空气中长期放置的"还原料",会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是"还原料"表面生成了难溶于水的________(填化学式)。
③沉淀器中反应的离子方程式为________。
(3)成品中 的含量可以用"碘量法"测得。称取 样品,置于碘量瓶中,移取 l的 溶液于其中,并加入乙酸溶液,密闭,置暗处反应 ,有单质硫析出。以淀粉溶液为指示剂,过量的 用 溶液滴定,反应式为 。测定时消耗 溶液体积 。终点颜色变化为________,样品中 的含量为________(写出表达式)。
硫代硫酸钠晶体(
)可用作定影剂、还原剂。回答下列问题:
(1)已知: , 。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀 、 溶液、 溶液、 溶液
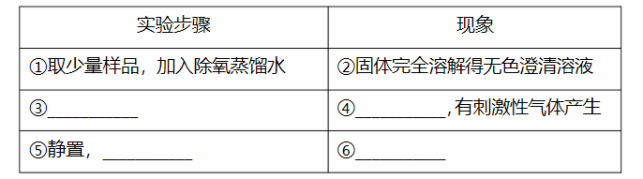
(2)利用 标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取 某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在________中溶解,完全溶解后,全部转移至 的________中,加蒸馏水至________。
②滴定:取 的 标准溶液 ,硫酸酸化后加入过量KI,发生反应: 。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应: 。加入淀粉溶液作为指示剂,继续滴定,当溶液________,即为终点。平行滴定3次,样品溶液的平均用量为 ,则样品纯度为________%(保留1位小数)。
用
滴定
溶液的滴定曲线如图所示。下列有关描述错误的是( )

| A. |
根据曲线数据计算可知 的数量级为 |
B. |
曲线上各点的溶液满足关系式 |
| C. |
相同实验条件下,若改为 , 反应终点c移到a |
D. |
相同实验条件下,若改为 , 反应终点c向b方向移动 |
下列实验操作不当的是 ( )
| A. |
用稀硫酸和锌粒制取 时,加几滴 溶液以加快反应速率 |
B. |
用标准HCl溶液滴定 溶液来测定其浓度,选择酚酞为指示剂 |
| C. |
用铂丝蘸取某碱金属的盐溶液灼烧,火焰呈黄色,证明其中含有 |
D. |
常压蒸馏时,加入液体的体积不超过圆底烧瓶容积的三分之二 |
(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图,回答下列问题:
(1)晒制蓝图时,用 作感光剂,以 溶液为显色剂.其光解反应的化学方程式为 ,显色反应的化学方程式为________.
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下面所示装置进行实验。
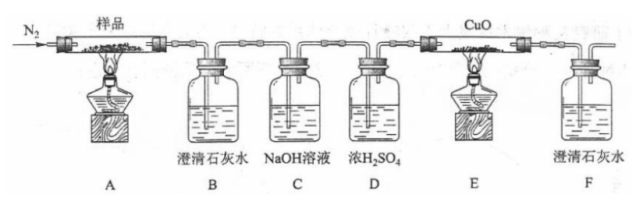
①通入氮气的目的是________。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有________、________。
③为防止倒吸,停止实验时应进行的操作是________。
④样品完全分解后,装置A中的残留物含有 和 ,检验 存在的方法是:________。
(3)测定三草酸合铁酸钾中铁的含量。
①称量 样品于锥形瓶中,溶解后加稀 酸化,用 溶液滴定至终点。滴定终点的现象是________。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中,加稀 酸化,用 溶液滴定至终点,消耗 溶液 ,该晶体中铁的质量分数的表达式为________。
聚合硫酸铁(PFS)是水处理中重要的絮凝剂,如图是以回收废铁屑为原料制备PFS的一种工艺流程.
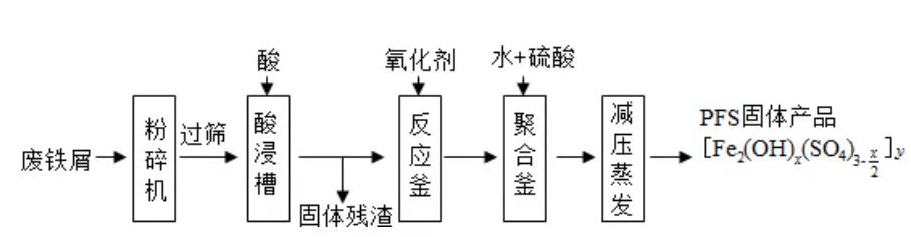
回答下列问题
(1)废铁屑主要为表面附有大量铁锈的铁,铁锈的主要成分为________.粉碎过筛的目的是________.
(2)酸浸时最合适的酸是________,写出铁锈与酸反应的离子方程式________.
(3)反应釜中加入氧化剂的作用是________,下列氧化剂中最合适的是________(填标号).
| A. |
|
B. |
|
C. |
|
D. |
|
(4)聚合釜中溶液的pH必须控制在一定的范围内,pH偏小时 水解程度弱,pH偏大时则________.
(5)相对于常压蒸发,减压蒸发的优点是________.
(6)盐基度B是衡量絮凝剂絮凝效果的重要指标,定义式为 (n为物质的量).为测量样品的B值,取样品 ,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用 的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰).到终点时消耗NaOH溶液 .按上述步骤做空白对照试验,消耗NaOH溶液 ,已知该样品中Fe的质量分数w,则B的表达式为________.
298K时,在 氨水中滴入 的盐酸,溶液的 与所加盐酸的体积关系如图所示。已知 氨水的电离度为 ,下列有关叙述正确的是

| A. |
该滴定过程应该选择酚酞作为指示剂 |
| B. |
点对应的盐酸体积为 |
| C. |
点处的溶液中 |
| D. |
点处的溶液中 |
试题篮
()