(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图,回答下列问题:
(1)晒制蓝图时,用 作感光剂,以 溶液为显色剂.其光解反应的化学方程式为 ,显色反应的化学方程式为________.
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下面所示装置进行实验。
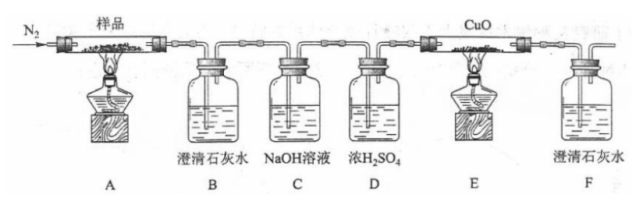
①通入氮气的目的是________。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有________、________。
③为防止倒吸,停止实验时应进行的操作是________。
④样品完全分解后,装置A中的残留物含有 和 ,检验 存在的方法是:________。
(3)测定三草酸合铁酸钾中铁的含量。
①称量 样品于锥形瓶中,溶解后加稀 酸化,用 溶液滴定至终点。滴定终点的现象是________。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中,加稀 酸化,用 溶液滴定至终点,消耗 溶液 ,该晶体中铁的质量分数的表达式为________。
醋酸亚铬[ ]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂,一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示,回答下列问题:

(1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是________,仪器a的名称是________。
(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开 , ,关闭 。
①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为________。
②同时c中有气体产生,该气体的作用是________。
(3)打开 ,关闭 和 。c中亮蓝色溶液流入d,其原因是________;d中析出砖红色沉淀,为使沉淀充分析出并分离,需采用的操作是________、________、洗涤、干燥。
(4)指出装置d可能存在的缺点________。
和 都是锂离子电池的电极材料,可利用钛铁矿(主要成分为 , 还含有少量MgO、 等杂质)来制备,工艺流程如下:
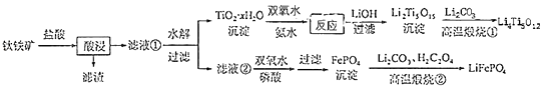
回答下列问题:
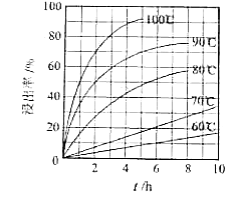
(1)"酸浸"实验中,铁的浸出率结果如下图所示.由图可知,当铁的净出率为70%时,所采用的实验条件为________.
(2)"酸浸"后,钛主要以 形式存在,写出相应反应的离子方程式________.
(3) 沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
|
温度/℃ |
30 |
35 |
40 |
45 |
50 |
|
92 |
95 |
97 |
93 |
88 |
分析40℃时 转化率最高的原因________.
(4) 中Ti的化合价为+4,其中过氧键的数目为________.
(5)若"滤液②"中 , 加入双氧水和磷酸(设溶液体积增加1倍),使 恰好沉淀完全即溶液中 , 此时是否有 沉淀生成?________(列式计算). 、 的分别为 、
(6)写出"高温煅烧②"中由FePO 4制备 的化学方程式________.
试题篮
()