如图是a、b、c三种固体物质的溶解度曲线,下列分析正确的是( )

| A. |
t 1℃时a、c两物质溶液中溶质的质量分数相等 |
| B. |
t 2℃时,物质a的100g饱和溶液中含有25g物质a |
| C. |
t 2℃时,分别将a、b、c的饱和溶液降温至t 1℃,溶质质量分数关系是b>a=c |
| D. |
t 2℃时向50g水中加入15g物质b充分搅拌,所得溶液质量一定小于65g |
如图为我国古代“布灰种盐”生产海盐的部分场景,其过程为“烧草为灰,布在滩场,然后以海水渍之,俟晒结浮白,扫而复淋”。
(1)“晒结浮白”是指海水浸渍的草灰经日晒后出现白色海盐颗粒的过程,化学上称之为 。
(2)经过多次“扫而复淋”,提高卤水浓度获得“上等卤水”(氯化钠的质量分数为15%),用于煎炼海盐。
①1000g“上等卤水”蒸干后,可得到氯化钠的质量约为 g。
②从燃料利用角度分析,用获得的“上等卤水”而不直接用海水煎炼海盐的原因是 。
③将“上等卤水”在100℃恒温蒸发至刚有晶体析出,所得溶液的组成为:150g溶液中含水 100g、NaCl 39.8g、MgCl2 7.65g及其他成分2.55g。将150g此溶液降温至20℃,有 g NaCl析出(溶解度见表)。此时, (填“有”或“没有”)MgCl2析出,原因是 。
|
温度/℃ |
20 |
60 |
100 |
|
|
溶解度/g |
NaCl |
36.0 |
37.3 |
39.8 |
|
MgCl2 |
54.8 |
61.3 |
73.0 |
|

硝酸钾和氯化钾两种物质的溶解度曲线见图1,这两种物质的溶解度见表。
|
温度/℃ |
10 |
20 |
30 |
40 |
50 |
60 |
|
|
溶解度/g |
甲 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
|
乙 |
31.0 |
34.0 |
37.0 |
40.0 |
42.6 |
45.5 |
请回答下列问题:
(1)观察溶解度曲线和溶解度表,判断物质乙是指 (填写化学式)。
(2)60℃时,饱和KNO 3溶液中混有少量KCl,应采用 的方法提纯KNO 3(填写"蒸发溶剂"或"冷却结晶")。
(3)60℃时,分别将等质量的KNO 3和KCl两种物质的饱和溶液温度降至t℃,析出晶体的质量关系为:KNO 3 KCl(填写">""="或"<")。
(4)如图2所示,20℃时,将一定质量的KNO 3固体放入盛水的试管中,发现有少量固体未溶解,向烧杯的水中加入某物质后,试管内固体能完全溶解。则加入的物质可以是 (填写字母标号)。

①冰块 ②生石灰固体 ③硝酸铵固体 ④干冰 ⑤浓硫酸 ⑥氢氧化钠固体
A.①③④
B.②⑤⑥
C.①③⑤
D.②④⑥
(5)60℃时,将45g KCl固体溶解于100g水中,降温至20℃,析出晶体的质量是 。
如图是甲、乙、丙三种固体物质的溶解度曲线。
(1)P点表示的含义为 。
(2)t1℃时,60g甲物质的饱和溶液升温到t2℃,再加 g甲物质,溶液仍然饱和。
(3)t2℃时,甲溶液中有少量丙,要提纯甲,用 结晶法。
(4)将t2℃时的甲、乙、丙的饱和溶液降温到t1℃,所得溶液中溶质的质量分数由大到小的顺序为 。

a、b是常见的两种固体物质,根据图表的信息回答下列问题:

物质b的溶解度表
|
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
b的溶解度/g |
14 |
20 |
30 |
45 |
65 |
85 |
110 |
(1)60℃时,物质a的溶解度是 g;
(2)20℃时,将20g物质b加入到50g水中,充分溶解后得到溶液的质量为 g;
(3)将50℃时a、b两物质的饱和溶液分别降温至20℃,所得溶液的溶质质量分数大小关系为a b(填">"、"="或者"<");
(4)下列说法正确的组合是 (填字母序号)。
①所有物质的溶解度都随温度的升高而增大
②30℃时,物质的溶解度a小于b
③物质b中含有少量a时,可以采用降温结晶的方法提纯b
④40℃时,分别将物质a、b的饱和溶液降温至10℃,析出物质的质量b大于a
A.①④B.①③C.②③D.②④
硝酸钾的溶解度曲线如图所示。下列说法正确的是( )

A.氢氧化钙的溶解度曲线与硝酸钾相似
B.A、B、C三点对应的溶液均为饱和溶液
C.溶质的质量分数:A>B>C
D.从硝酸钾溶液中获得晶体的方法:蒸发浓缩、冷却结晶
图中是a、b、c三种物质的溶解度曲线,回答下列问题。
(1)P点的含义: 。
(2)在t3℃时,将120g a物质加入到200g水中,充分溶解后所得到的溶液质量为 g。
(3)b中混有少量a,提纯b的方法是 (选填“蒸发结晶”或“降温结晶”)。
(4)分别将t3℃时a、b的饱和溶液降温到t2℃,析出晶体的质量大小关系为 (选填一个序号)。
①a>b
②a<b
③a=b
④均有可能

如图为甲、乙、丙三种固体物质的溶解度曲线,请回答。
(1)t1℃时,甲、乙、丙三种物质的溶解度大小关系是 。
(2)甲中混有少量乙,若要提纯甲,可采取的结晶方法是 。
(3)t2℃时,将50g丙物质放入100g水中充分溶解, 所得溶液中溶质和溶液的质量比为 (填最简整数比)。
(4)t3℃时,将等质量的甲、乙、丙三种物质的饱和溶液分别降温到t1℃,所得溶液的质量由大到小的顺序是 。

如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法正确的是( )

A.在t2℃时,甲、乙两物质的溶解度相等
B.在t1℃时,甲、乙、丙三种物质的饱和溶液中,溶质甲的质量最大
C.甲中混有少量乙时,宜采用降温结晶的方法提纯甲
D.将t3℃的甲、乙、丙三种物质的饱和溶液降温至t1℃时,只有丙溶液仍是饱和溶液
将200g溶有物质M的溶液从95℃降低到10℃,不同温度时析出溶质M的质量如下表所示。下列说法正确的是( )
|
温度/℃ |
95 |
90 |
80 |
30 |
10 |
|
析出M的质量/g |
0 |
0 |
15 |
100 |
116 |
A.95℃时该溶液为饱和溶液
B.M的溶解度随温度的升高而减小
C.30℃时析出M后所得溶液中含100g水
D.从M的不饱和溶液中析出M可采用先蒸发溶剂、再冷却结晶的方法
甲、乙试管中各盛有10.0g水,向其中一支中加入3.0g KNO3固体,另一支中加入3.0g NaCl固体,按图1进行实验(KNO3和NaCl的溶解度曲线如图2),下列说法正确的是( )

A.甲中加入的固体是KNO3
B.0℃时,甲中溶液可能饱和,乙中溶液一定饱和
C.KNO3中含有少量NaCl杂质,可用冷却KNO3热饱和溶液的方法提纯
D.40℃时,若使图1中甲、乙试管内的溶液恰好变为相应饱和溶液,甲中加入对应的溶质质量大于乙中加入对应的溶质质量
根据所给氯化钠和碳酸钠的溶解度及溶解度曲线的信息,回答下列问题:
|
温度 |
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
|
氯化钠 溶解度/g |
35 |
35.5 |
36 |
36.5 |
37 |
|
碳酸钠溶解度/g |
6 |
10 |
18 |
36.5 |
50 |
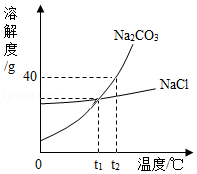
(1)t1℃时,NaCl的溶解度是 g。
(2)t2℃时,将40g Na2CO3固体加入50g水中,充分溶解后所得Na2CO3溶液中溶质与溶剂的质量比为 。
(3)若Na2CO3中混有少量的NaCl,提纯Na2CO3应采取的方法是 (填“降温结晶”或“蒸发结晶”)
海水是巨大的资源宝库.如图是某工厂对海水资源综合利用的示意图.
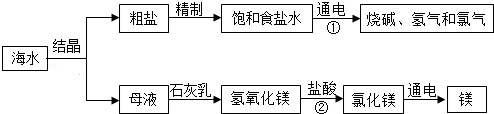
(1)分离粗盐和母液的操作名称为 ;母液中一定含有的金属元素为 ;
(2)步骤①的化学方程式是 ;
步骤②的基本反应类型为 .
(3)表为氯化钠在不同温度时的溶解度;结合表中数据回答:
|
温度/℃ |
30 |
50 |
70 |
100 |
|
溶解度/g |
36.3 |
37.0 |
37.8 |
39.8 |
50℃时,氯化钠饱和溶液中溶质的质量分数为 ;从海水中获取粗盐,宜选用 (填"蒸发结晶"或"降温结晶")
硝酸钾的溶解度随温度升高而增大。如图是有关硝酸钾溶液的实验操作及变化情况。下列说法正确的是( )

| A. |
操作I一定是降温 |
B. |
①与②的溶液质量一定相等 |
| C. |
①与③的溶质质量一定相等 |
D. |
②与③的溶质质量分数一定相等 |
试题篮
()