二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下: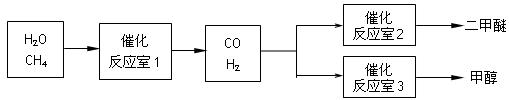
请填空:
(1)在一定条件下,反应室1中发生反应:CH4(g)+H2O(g) CO(g)+3H2(g) △H>0。
CO(g)+3H2(g) △H>0。
在其它条件不变的情况下降低温度,逆反应速率将 (填“增大”、“减小”或“不变”)。将1.0molCH4和2.0molH2O通入反应室1(假设容积为100L),10min末有0.1molCO生成,则10min内反应的平均速率V(H2)= 。
(2)在一定条件下,已知反应室2的可逆反应除生成二甲醚外还生成了气态水,其化学方程式为 。
(3)在压强为0.1MPa条件下,反应室3(容积为VL)中amolCO与2amolH2在催化剂作用下反应生成甲醇:CO(g) +2H2(g)  CH3OH(g),CO的平衡转化率与温度、压强的关系如右图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如右图所示,则:
① P1 P2 (填“<”、“>”或“=")。
②在其它条件不变的情况下,反应室3再增加amolCO与2amolH2,达到新平衡时,CO的转化率______(填“增大”、“减小”或“不变”。下同。),平衡常数 。
③在P1压强下,100℃时,CH3OH(g)  CO(g) + 2H2(g)反应的平衡常数为
CO(g) + 2H2(g)反应的平衡常数为
(用含a、V的代数式表示)。








 粤公网安备 44130202000953号
粤公网安备 44130202000953号