氢氧两种元素形成的常见物质有H2O与H2O2,在一定条件下均可分解。
(1)已知:
| 化学键 |
断开1mol化学键所需的能量(kJ) |
| H—H |
436 |
| O—H |
463 |
| O=O |
498 |
①H2O的电子式是 。
②H2O(g)分解的热化学方程式是 。
③11.2 L(标准状况)的H2完全燃烧,生成气态水,放出 kJ的热量。
(2)某同学以H2O2分解为例,探究浓度与溶液酸碱性对反应速率的影响。常温下,按照如表所示的方案完成实验。
| 实验编号 |
反应物 |
催化剂 |
|
| a |
50 mL 5% H2O2溶液 |
|
1 mL 0.1 mol·L-1 FeCl3溶液 |
| b |
50 mL 5% H2O2溶液 |
少量浓盐酸 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
| c |
50 mL 5% H2O2溶液 |
少量浓NaOH溶液 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
| d |
50 mL 5% H2O2溶液 |
|
MnO2 |
①测得实验a、b、c中生成氧气的体积随时间变化的关系如图1所示。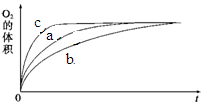
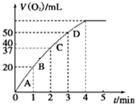
图1 图2
由该图能够得出的实验结论是_________。
②测得实验d在标准状况下放出氧气的体积随时间变化的关系如图2所示。解释反应速率变化的原因: 。








 粤公网安备 44130202000953号
粤公网安备 44130202000953号