在气体反应中,能使反应物活化分子数和活化分子百分数同时增加的方法是①增加反应物的浓度 ②升高温度 ③移去生成物 ④增大压强 ⑤加入催化剂
| A.①③ | B.①⑤ | C.②⑤ | D.②④ |
下列说法正确的是
| A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而增大有效碰撞的次数 |
| B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 |
| C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 |
| D.催化剂不影响反应活化能但能增大单位体积内活化分子的百分数,从而增大反应速率 |
下列相关实验能达到预期目的的是( )
| 相关实验 |
预期目的 |
|
| A |
相同温度下,将等质量的大理石块、大理石粉末分别加入等体积、等浓度的盐酸和醋酸中,观察气泡产生的快慢 |
验证固体接触面积对化学反应速率的影响 |
| B |
可逆反应FeCl3(aq)+3KSCN(aq) Fe(SCN)3(aq)+3KCl(aq)建立平衡后,在其它条件不变时,加入KCl固体,观察体系颜色的变化 Fe(SCN)3(aq)+3KCl(aq)建立平衡后,在其它条件不变时,加入KCl固体,观察体系颜色的变化 |
验证浓度对化学平衡的影响 |
| C |
室温下,向BaSO4悬浊液中加入饱和Na2CO3溶液,过滤后,再向沉淀中加入盐酸,沉淀部分溶解 |
验证BaSO4和BaCO3Ksp的相对大小 |
| D |
相同温度下,两支试管中装有等体积、等浓度的H2O2溶液,向其中分别加入少量FeCl3固体和少量的MnO2固体 |
验证不同催化剂对H2O2分解速率的影响 |
一定温度下,取pH=12的NaOH溶液和氨水各10 mL,分别用蒸馏水冲稀至1 L。关于稀释后的溶液的pH的说法正确的是
| A.NaOH溶液的pH小于氨水的pH | B.NaOH溶液的pH大于氨水的pH |
| C.两溶液的pH相等 | D.无法判别两溶液pH的相对大小 |
某学习小组研究“不同条件对化学反应速率影响的探究”,选用4 mL 0.01 mol·L-1KMnO4溶液与2 mL 0.1 mol·L-1 H2C2O4溶液在稀硫酸中进行实验,改变条件如表:
| 组别 |
草酸的体积 /mL |
温度/℃ |
其它物质 |
| ① |
2 mL |
20 |
|
| ② |
2 mL |
20 |
2滴饱和MnSO4溶液 |
| ③ |
2 mL |
30 |
|
| ④ |
1 mL |
20 |
1 mL蒸馏水 |
(1)如果研究催化剂对化学反应速率的影响,使用实验 和 (用 ①~④表示,下同);如果研究温度对化学反应速率的影响,使用实验 和 。
(2)对比实验①和④,可以研究 对化学反应速率的影响,实验④中加入1 mL蒸馏水的目的是 。
某研究小组利用“钯催化交叉偶联反应”合成了有机物丙,合成路线如下:
下列分析判断正确的是
| A.分离提纯有机物丙宜在NaOH热溶液中进行 |
| B.PbCl2的作用是提高反应物的活性,加快反应速率 |
| C.可用酸性KMnO4溶液检验有机物丙中是否含有机物乙 |
| D.利用NaOH溶液、AgNO3溶液即可确定有机物甲中含有溴元素 |
下列说法正确的是
| A.活化分子间所发生的碰撞为有效碰撞 |
| B.由C(s,石墨)=C(s,金刚石) △H>0可知,金刚石比石墨稳定 |
| C.NH4HCO3(s) =NH3(g)+H2O(g)+CO2(g) ΔH=+185.57 kJ/mol能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 |
| D.有气体参与的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子总数,从而使反应速率增大 |
下列反应条件的控制中不恰当的是
| A.为防止铁生锈,在其表面涂一层防锈油漆 |
| B.为防止火灾,在面粉厂、加油站等场所要严禁烟火 |
| C.为加快KClO3的分解速率,加入MnO2 |
| D.为加快H2O2的分解速率,把反应容器放到冷水中冷却 |
对于硫酸工业中SO2的催化氧化反应 2SO2+O2 2SO3,下列说法错误的是
2SO3,下列说法错误的是
| A.使用催化剂能加快化学反应速率 |
| B.增大O2浓度可以使SO2转化率达到100% |
| C.降低反应温度,化学反应速率减慢 |
| D.增大O2浓度,化学反应速率增大 |
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量可向盐酸中加入适量的
| A.NaOH固体 | B.同浓度的醋酸溶液 | C.NH4Cl固体 | D.CH3COONa固体 |
用锌片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是
| A.加热 | B.改用98%的浓硫酸 |
| C.改用锌粒 | D.滴加少量CuSO4溶液 |
已知:反应2A+3B=C+D在某段时间内,以A的浓度变化表示的反应速率为1mol/(L·min),则此段时间内,以C的浓度变化表示的化学反应速率为
| A.0.5 mol/(L·min) | B.2mol/(L·s) | C.2mol/(L·min) | D.3mol/(L·min) |
某化学兴趣小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4 + 5H2C2O4 + 3H2SO4 ="=" K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
【实验内容及记录】
| 实验编号 |
室温下,试管中所加试剂及其用量 / mL |
室温下溶液颜色褪至无色所需时间 / min |
|||
| 0.6 mol/L H2C2O4溶液 |
H2O |
0.2 mol/L KMnO4溶液 |
3 mol/L 稀硫酸 |
||
| 1 |
3.0 |
2.0 |
3.0 |
2.0 |
4.0 |
| 2 |
3.0 |
3.0 |
2.0 |
2.0 |
5.2 |
| 3 |
3.0 |
4.0 |
1.0 |
2.0 |
6.4 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是 。
(2)利用实验1数据计算,用KMnO4的浓度变化表示反应速率 v(KMnO4)= 。
(3)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图甲所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图乙所示。 该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究。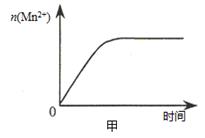
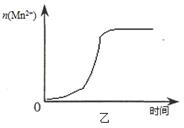
①该小组同学提出的假设是 。
②请你帮助该小组同学完成实验方案,并选择表中空白处应加入的物质。
| 实验编号 |
室温下,试管中所加试剂及其用量 / mL |
再向试管中加入少量固体 |
室温下溶液颜色褪至无色所需时间 / min |
|||
| 0.6 mol/L H2C2O4溶液 |
H2O |
0.2 mol/L KMnO4溶液 |
3 mol/L 稀硫酸 |
|||
| 4 |
3.0 |
2.0 |
3.0 |
2.0 |
 |
A.KMnO4 B.H2C2O4 C.K2SO4 D.MnSO4
③若该小组同学提出的假设成立,应观察到的现象是 。
已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应。某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,探究不同的初始pH和草酸溶液浓度对反应速率的影响,设计如下实验,则A=________,C=___________,E=___________
| 实验编号 |
温度 |
初始pH |
0.1mol/L草酸溶液体积/mL |
0.01mol/LKMnO4 溶液体积/mL |
蒸馏水体积/mL |
待测数据(混合液褪色时间/s) |
| ① |
常温 |
1 |
20 |
50 |
30 |
t1 |
| ② |
常温 |
A |
B |
C |
30 |
t2 |
| ③ |
常温 |
2 |
40 |
D |
E |
t3 |
(2)该反应的离子方程式_____________________________。
(3)若t1<t2,则根据实验①和②得到的结论是________________________。
(4)小组同学发现每组实验反应速率随时间的变化总是如图,其中t1~t2时间内速率变快的主要原因可能是:①__________________;②_________________。
(5)化学小组用滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O4•2H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定三次,平均消耗KMnO4溶液VmL。滴定到达终点的现象是:__________;实验中所需的定量仪器有__________(填仪器名称)。该KMnO4溶液的物质的量浓度为________mol/L。
某探究小组用酸性KMnO4溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素。实验条件作如下限定:催化剂的用量可选择0.5g、0g,酸性KMnO4溶液的浓度可选择0.01mol·L﹣1、0.001mol·L﹣1,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4 mL,H2C2O4溶液(0.1mol·L﹣1 )的用量均为2mL。
(1)该反应的离子方程式: 。
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 |
T/K |
催化剂的用量/g |
KMnO4酸性溶液的浓度/mol·L﹣1 |
实验目的 |
| ① |
298 |
0.5 |
0.01 |
(Ⅰ )实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; (Ⅱ )实验①和③探究温度对该反应速率的影响; (Ⅲ )实验①和 探究催化剂对该反应速率的影响 |
| ② |
||||
| ③ |
||||
| ④ |
(3)在完成探究催化剂对该反应速率影响的实验时发现,未加催化剂的情况下,刚开始一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快。针对上述实验现象,同学认为高锰酸钾与草酸溶液的反应放热,导致溶液温度升高,反应速率加快,从影响化学反应速率的因素看,你猜想还可能是 。若用实验证明你的猜想.除酸性高锰酸钾溶液,草酸溶液外,还需要选择的试剂最合理的是 。
A.硫酸钾 B.硫酸锰 C.二氧化锰 D.水
(4)可以利用酸性高锰酸钾测定某草酸钠(Na2C2O4)样品中草酸钠的质量分数,该小组称量2.68 g草酸钠样品溶于稀硫酸中,然后用0.2000 mol·L﹣1的酸性高锰酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应 )。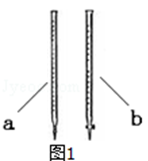
①滴定前是否要滴加指示剂? (填“是”或“否” ),当溶液 ,说明滴定达到终点。
②滴定时用 (填a或b )滴定管盛装KMnO4标准溶液。
③达到终点时消耗了15.00 mL的高锰酸钾溶液,样品中草酸钠的质量分数为 。
试题篮
()