硫酸的产量是衡量一个国家化工水平的标志。2SO2(g) + O2(g)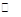 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。
| |
甲 |
乙 |
丙 |
|
| 起始物质的量 |
n(SO2) / mol |
0.4 |
0.4 |
0.8 |
| n(O2) / mol |
0.24 |
0.48 |
0.48 |
|
| SO2的平衡转化率 |
80% |
α1 |
α2 |
|
下列判断中,正确的是( )
A.甲中反应的平衡常数大于乙 B.平衡时,SO2的转化率:α1<80%<α2
C.该温度下,乙中平衡常数值为400 D.平衡时,丙中c(SO3)是甲中的2倍








 粤公网安备 44130202000953号
粤公网安备 44130202000953号