甲醇(CH3OH)是一种可再生能,具有开发和应用的广阔前景,工业上一般可采用如下反应合成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
(1)t℃时,往1L密闭容器中充入1mol CO和2molH2。10min后,反应达到平衡,并测得CH3OH(g)的浓度为0.8 mol·L-1。
①该时间内反应速率v(H2) =____。t℃时,该反应的化学平衡常数K= (mol·L-1)-2
②下列各项中,能说明该反应已达到平衡的是_____________(填序号)
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,测得v正(CO) =v逆(CH3OH)
c.恒温、恒容条件下,容器内的气体密度不发生变化
d.一定条件下,单位时间内消耗2 mol H2,同时生成1 mol CH3OH(g)
(2)下图是该反应在T1 、T2温度下CO的转化率随时间变化的曲线。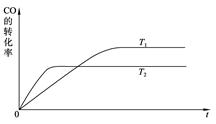
①该反应的焓变ΔH____0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1____________K2(填“>”、“<”或“=”)。
③若保持容器容积不变,下列措施可增加甲醇产率的是______________。
a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =-a kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH =-b kJ·mol-1
则,CH3OH(l)+O2(g) =CO(g)+2H2O(g) ΔH=____________kJ·mol-1。
(4)我国在甲醇燃料电池技术方面已获得重大突破。甲醇燃料电池的工作原理如图所示。
①该电池工作时,b口通入的物质为______。
②该电池正极的电极反应式为 。








 粤公网安备 44130202000953号
粤公网安备 44130202000953号