T1温度下,反应2SO2(g)+O2(g)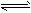 2SO3(g) △H<0的平衡常数K=532.4。
2SO3(g) △H<0的平衡常数K=532.4。
(1)该反应平衡常数的表达式为K= ,T1温度下,某时刻测得体系中各物质浓度分别为c(SO2)="0.0600" mol·L-1,c(O2)="0.400" mol·L-1,c(SO3)=2.000mol·L-1,此时反应进行的方向为 。
(2)该反应△S 0,升高温度,平衡常数 (填“增大”“减小”或“不变”)
(3)T2温度下,2L容积固定的甲、乙两密闭容器中发生上述反应,测得平衡时有关数据如下:
| 容器 |
甲 |
乙 |
| 反应物投入量 |
2molSO2、1molO2 |
4molSO3 |
| 平衡时n(SO3)/mol |
1 |
m |
| 反应物的转化率 |
1 |
2 |
①下列能说明T2温度下甲容器中上述反应已达到平衡状态的是 。
A.SO2、O2、SO3的物质的量浓度之比为2:1:2
B.容器内气体压强不再变化
C.单位时间内2v(SO2)消耗= v(O2)生成
D.容器内混合气体的密度不再变化
②分析表格中数据,1+2 1(填“>”“=”或“<”),T1 T2(填“>”“=”或“<”)。








 粤公网安备 44130202000953号
粤公网安备 44130202000953号