Ⅰ.下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。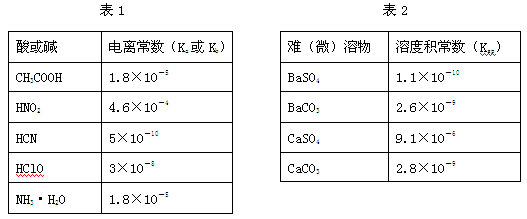
请回答下面问题:
(1)下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是 (填序号)。
| A.升高温度 | B.加水稀释 |
| C.加少量的CH3COONa固体 | D.加少量冰醋酸 |
(2)CH3COONH4的水溶液呈 (选填“酸性”、“中性”、“碱性”)。
(3)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使c(SO42-)达到0.0l mol/L以上,则溶液中c(CO32-)应不低于 mol/L。
Ⅱ.化学在能源开发与利用中起着重要的作用,如甲醇、乙醇、二甲醚(CH3OCH3)等都是新型燃料。
(1)乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。
2CO2(g)+6H2(g) 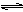 CH3CH2OH(g)+3H2O(g) △H=a kJ/mol
CH3CH2OH(g)+3H2O(g) △H=a kJ/mol
在一定压强下,测得上述反应的实验数据如下表。
根据表中数据分析:
①上述反应的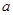 0(填“大于”或“小于”)。
0(填“大于”或“小于”)。
②在一定温度下,提高氢碳(即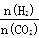 )比,平衡常数K值 (填“增大”、“减小”、或“不变”)。
)比,平衡常数K值 (填“增大”、“减小”、或“不变”)。
(2)催化剂存在的条件下,在固定容积的密闭容器中投入一定量的CO和H2,同样可制得乙醇(可逆反应)。该反应过程中能量变化如图所示: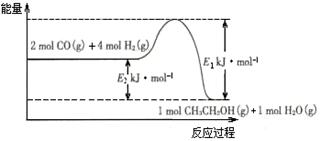
①写出CO和H2制备乙醇的热化学反应方程式 。
②在一定温度下,向上述密闭容器中加入1 mol CO、3 mol H2及固体催化剂,使之反应。平衡时,反应产生的热量为Q kJ,若温度不变的条件下,向上述密闭容器中加入4 mol CO、12 mol H2及固体催化剂,平衡时,反应产生的热量为w kJ,则w的范围为 。
(3)二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效的优良性能。以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,其工作原理与甲烷燃料电池原理相类似。该电池中负极上的电极反应式是 。








 粤公网安备 44130202000953号
粤公网安备 44130202000953号