工业制硫酸的过程中利用反应2SO2(g)+O2(g)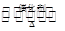 2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收.请回答下列问题:
2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收.请回答下列问题:
(1)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2发生反应,则下列说法正确的是 .
| A.若反应速率v(SO2)=v(SO3),则可以说明该可逆反应已达到平衡状态 |
| B.保持温度和容器体积不变,充入2mol N2,化学反应速率加快 |
| C.平衡后仅增大反应物浓度,则平衡一定右移,各反应物的转化率一定都增大 |
| D.平衡后移动活塞压缩气体,平衡时SO2、O2的百分含量减小,SO3的百分含量增大 |
E.保持温度和容器体积不变,平衡后再充入2molSO3,再次平衡时各组分浓度均比原平衡时的浓度大
F.平衡后升高温度,平衡常数K增大
(2)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
| 实验编号 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| SO2 |
O2 |
SO2 |
O2 |
|||
| 1 |
T1 |
4 |
2 |
x |
0.8 |
6 |
| 2 |
T2 |
4 |
2 |
0.4 |
y |
9 |
①实验1从开始到反应达到化学平衡时,v(SO2)表示的反应速率为 ,表中y= .
②T1 T2,(选填“>”、“<”或“=”),实验2中达平衡时 O2的转化率为 .
(3)尾气SO2用NaOH溶液吸收后会生成Na2SO3.现有常温下0.1mol/L Na2SO3溶液,实验测定其pH约为8,完成下列问题:
①该溶液中c(Na+)与c(OH﹣)之比为 .
②该溶液中c(OH﹣)=c(H+)+ + (用溶液中所含微粒的浓度表示).
③当向该溶液中加入少量NaOH固体时,c(SO32﹣) ,c(Na+) .(选填“增大”、“减小”或“不变”)








 粤公网安备 44130202000953号
粤公网安备 44130202000953号