工业常用燃料与水蒸气反应制备H2和CO, 再用H2和CO合成甲醇。
(1)制取H2和CO通常采用:C(s)+H2O(g)  CO(g)+H2(g) △H=+131.4 kJ·mol-1,下列判断正确的是 。
CO(g)+H2(g) △H=+131.4 kJ·mol-1,下列判断正确的是 。
a.该反应的反应物总能量小于生成物总能量
b.标准状况下,上述反应生成1L H2气体时吸收131.4 kJ的热量
c.若CO(g)+H2(g) C(s)+H2O(1) △H=-QkJ·mol-1,则Q<131.4
C(s)+H2O(1) △H=-QkJ·mol-1,则Q<131.4
d.若C(s)+CO2(g) 2CO(g) △H1;CO(g)+H2O(g)
2CO(g) △H1;CO(g)+H2O(g) H2(g)+CO2(g) △H2则:△H1+△H2=+131.4 kJ·mol-1
H2(g)+CO2(g) △H2则:△H1+△H2=+131.4 kJ·mol-1
(2)甲烷与水蒸气反应也可以生成H2和CO,该反应为:CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
已知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如下表:
| |
不同时间各物质的物质的量/mol |
|||
| 0 min |
2min |
4min |
6min |
|
| CH4 |
2.00 |
1.76 |
1.60 |
n2 |
| H2 |
0.00 |
0.72 |
n1 |
1.20 |
根据表中数据计算:
①0 min~2min内H2的平均反应速率为 。
②达平衡时,CH4的转化率为 。在上述平衡体系中再充入2.00mol甲烷和1.00mol水蒸气,达到新平衡时H2的体积分数与原平衡相比 (填“变大”、“变小”或“不变”),可判断该反应达到新平衡状态的标志有______。(填字母)
a.CO的含量保持不变
b.容器中c(CH4)与c(CO)相等
c.容器中混合气体的密度保持不变
d.3ν正(CH4)=ν逆(H2)
(3)合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的。工作原理如下图(c为隔膜,甲醇不能通过,其它离子和水可以自由通过)。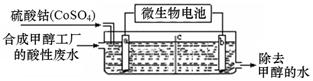
①a电极的名称为 。
②写出除去甲醇的离子方程式 。
③微生物电池是绿色酸性燃料电池,写出该电池正极的电极反应式为 。








 粤公网安备 44130202000953号
粤公网安备 44130202000953号