在一定温度下,将6 mol C02和8 mol H2充入2L恒容密闭容器中,发生如下反应:
CO2(g) + 3H2(g)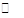 CH30H(g) + H20(g) △H < O
CH30H(g) + H20(g) △H < O
分别在t时测得在该容器内n(H2)的数值如下:
| t/min |
1 |
4 |
8 |
11 |
| n(H2)/mol |
6 |
2.6 |
2 |
2 |
则下列说法正确的是
A.该温度下,平衡常数K = 0.5
B.反应进行4min时,V正(C02) =" 0.45" mol/(L·min)
C.反应进行到9min时,H2的转化率比8min时高
D.反应进行11min后,若增大容器内压强,CO2的转化率一定增大








 粤公网安备 44130202000953号
粤公网安备 44130202000953号