(14分)尿素是蛋白质代谢的产物,也是重要的化学肥料。工业合成尿素反应如下:
2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图所示。
A点的正反应速率v正(CO2)_______B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);
氨气的平衡转化率为________________________。
(2)氨基甲酸铵是合成尿素的一种中间产物。将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)  NH2COONH4(s)
NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
| 温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡气体总浓度 (10-3mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①关于上述反应的焓变、熵变说法正确的是 。
A.∆H<0, ∆S<0 B.∆H>0, ∆S<0
C.∆H>0, ∆S>0 D.∆H<0, ∆S>0
②关于上述反应的平衡状态下列说法正确的是________________
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
③氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底。将氨基甲酸铵粉末逐渐加入1 L0.1 mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052 mol氨基甲酸铵,此时溶液中几乎不含碳元素。此时溶液中c(NH4+ )= ;
NH4+ 水解平衡常数值为 。
(3)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电。尿素燃料电池结构如图所示,写出该电池的负极反应式: 。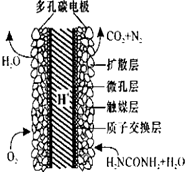








 粤公网安备 44130202000953号
粤公网安备 44130202000953号