合成氨工业对国民经济和社会发展具有重要的意义.根据已学知识回答下列问题:
(1)对于密闭容器中的反应:N2(g)+3H2(g)═2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示.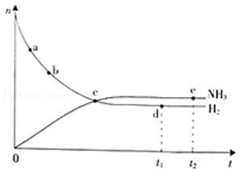
下列叙述正确的是 (填选项).
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大
(2)已知N2(g)+3H2(g)═2NH3(g)△H=﹣92.4kJ•mol﹣1
①合成氨工业采取的下列措施不可用平衡移动原理解释的是 (填选项).
A.采用较高压强(20MPa~50MPa)
B.采用500℃的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来
②在容积均为2L(容器体积不可变)的甲、乙两个容器中,分别加入2molN2、6molH2和1molN2、3molH2,在相同温度、催化剂下使其反应.最终达到平衡后,两容器N2转化率分别为α甲、α乙,则甲容器中平衡常数表达式为 (用含α甲的代数式表示,化简为最简式),此时α甲 α乙(填“>”、“<”“=”).








 粤公网安备 44130202000953号
粤公网安备 44130202000953号