(17分)氮及其化合物在工业生产和科技等领域有广泛应用。
(1)肼(N2H4)常用于火箭或原电池的燃料。已知:(i)N2(g)+2O2(g)=2NO2(g) ΔH=+67.7kJ/mol
(ii)N2H4(g)+ O2(g)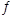 N2(g)+2H2O(g) ΔH=-534kJ/mol
N2(g)+2H2O(g) ΔH=-534kJ/mol
(iii)H2O(g)= H2O(1) ΔH=-44kJ/mol
①反应2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l) ΔH =_______kJ·mol-1
②一定温度下,将N2H4与NO2以体积比1:1置于10 L密闭容器中发生反应2N2H4(g)+ 2NO2(g)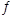 3N2(g)+4H2O(1),下列不能说明反应达到平衡状态的是_______。(填序号)
3N2(g)+4H2O(1),下列不能说明反应达到平衡状态的是_______。(填序号)
a.混合气体密度保持不变 b.混合气体颜色保持不变
c.N2H4与NO2体积比保持不变 d.体系压强保持不变
③在10 L的密闭容器中发生上述反应,容器内部分物质的物质的量变化如下表:
前2min内NO2的平均反应速率为___________。平衡时NO2的转化率________;该温度下反应的平衡常数K=_________。
反应在第6min时改变了条件,改变的条件可能是__________。(填序号)
a.使用催化剂 b.升高温度 c.减小压强 d.增加NO2的量
(2)HNO3和As2S3能发生反应:As2S3+10HNO3==2H3AsO4+3S+10NO2↑+2H2O,反应中被氧化的元素为_________。
若该反应中转移电子的物质的量为5 mol时,产物中的S经过转化全部生成浓H2SO4,然后与足量的铜在加热条件下反应消耗铜的量_________。(填序号)
a.小于0.75 mol b.等于0.75mol c.大于0.75mol d.无法确定








 粤公网安备 44130202000953号
粤公网安备 44130202000953号