合成氨反应为:N2(g)+3H2(g)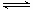 2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2 L的密闭容器中反应时N2的物质的量随时间的变化曲线,图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。下列说法正确的是
2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2 L的密闭容器中反应时N2的物质的量随时间的变化曲线,图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。下列说法正确的是

A.由图1可得加入适当的催化剂,E和ΔH都减小
B.图2中0~10 min内该反应的平均速率v(H2)=0.045 mol·L-1·min-1,从11 min起其他条件不变,压缩容器的体积为1 L,则n(N2)的变化曲线为d
C.图3中A、B、C三点所处的平衡状态中,反应物N2的转化率最高的是B点
D.图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2








 粤公网安备 44130202000953号
粤公网安备 44130202000953号