氨气是重要化工产品之一。传统的工业合成氨技术的反应原理是:
N2(g)+3H2(g) 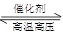 2NH3(g) ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一固定容积的密闭容器中反应,反应过程中各种物质的量变化如图所示,回答下列问题:
2NH3(g) ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一固定容积的密闭容器中反应,反应过程中各种物质的量变化如图所示,回答下列问题:

(1)计算反应在第一次平衡时的平衡常数K= 。(保留二位小数)
(2)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 。
(3)45 min时刻改变的条件是 。
(4)产物NH3在5~10 min、25~30min和45~50 min时平均反应速率从大到小的排列次序为 (平均反应速率分别以v1、v2、v3表示)。
(5)随着条件的改变,达到三次平衡时H2的转化率也发生[了变化,如分别以α1、α2、α3表示,其中最小的是 。
(6)请在图中用实线表示25~45、45~60min 两阶段化学平衡常数K的变化图像。









 粤公网安备 44130202000953号
粤公网安备 44130202000953号