乙醇是重要的有机化工原料,可由乙烯直接水合法或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H)。再水解生成乙醇。写出相应的反应的化学方程式 。
(2)已知:乙烯气相直接水合反应如下:
C2H4(g)+H2O(g) 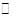 C2H5OH(g) H=-45.5KJ/mol
C2H5OH(g) H=-45.5KJ/mol
下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中n(H2O):n(C2H4)=1:1)
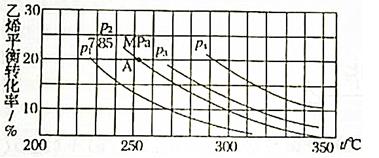
①计算乙烯水合制乙醇反应在图中A点的平衡常数Kp= (Kp表示用平衡分压代替平衡浓度计算出的平衡常数的值,分压=总压×物质的量分数)
②图中压强P1、P2、P3、P4的大小顺序为: ,理由是 。
(3)若某温度下,反应C2H4(g)+H2O(g) 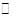 C2H5OH(g)的平衡常数为Kp=0.05MPa-1,体系总压为8.00MPa,各物质的量分数如下表所示。
C2H5OH(g)的平衡常数为Kp=0.05MPa-1,体系总压为8.00MPa,各物质的量分数如下表所示。
| 物质 |
C2H4(g) |
H2O(g) |
C2H5OH(g) |
| 物质的量分数 |
0.25 |
0.25 |
0.5 |
则v(正) v(逆)(填“>”“<”“=”)。








 粤公网安备 44130202000953号
粤公网安备 44130202000953号