工业制硝酸的主要反应为:4NH3 (g) +5O2 (g)  4NO(g) + 6H2O(l) △H
4NO(g) + 6H2O(l) △H
(1)已知氢气的燃烧热为285.8kJ/mol。
N2(g)+3H2(g)═ 2NH3(g)△H = ﹣92.4kJ/mol;
N2(g)+ O2(g)═ 2NO(g)△H = +180.6kJ/mol。
则上述工业制硝酸的主要反应的△H= 。
(2)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
| 浓度 |
c(NH3)(mol/L) |
c(O2)(mol/L) |
c(NO)(mol/L) |
| 起始 |
0.8 |
1.6 |
0 |
| 第2min |
0.6 |
a |
0.2 |
| 第4min |
0.3 |
0.975 |
0.5 |
| 第6min |
0.3 |
0.975 |
0.5 |
| 第8min |
0.7 |
1.475 |
0.1 |
①反应在第2min到第4min时,O2的平均反应速率为 。
②反应在第6min时改变了条件,改变的条件可能是 (填序号)。
A.使用催化剂 B.升高温度 C.减小压强 D.增加O2的浓度
③下列说法中能说明4NH3(g) + 5O2(g)  4NO(g) + 6H2O(g)达到平衡状态的是_________ (填序号)。
4NO(g) + 6H2O(g)达到平衡状态的是_________ (填序号)。
A.单位时间内生成n mol NO的同时,生成n mol NH3
B.条件一定,混合气体的平均相对分子质量不再变化
C.百分含量w(NH3)=w(NO)
D.反应速率v(NH3):v(O2):v(NO):v(H2O) = 4:5:4:6
E.若在恒温恒压下容积可变的容器中反应,混合气体的密度不再变化
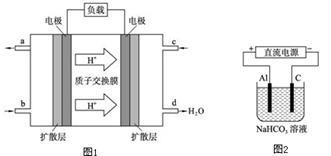
(3)某研究所组装的CH3OH﹣O2燃料电池的工作原理如图1所示。
①该电池工作时,b口通入的物质为 。
②该电池正极的电极反应式为: 。
③以此电池作电源,在实验室中模拟铝制品表面“钝化”处理(装置如图2所示)的过程中,发现溶液逐渐变浑浊并有气泡产生,其原因可能是 (用相关的离子方程式表示)。








 粤公网安备 44130202000953号
粤公网安备 44130202000953号