t 1℃时,将a、b两种固体各18g,分别加入到盛有100g水的烧杯中,充分搅拌后现象如图甲所示,升温到t 2℃时,现象如图乙所示,a、b两种固体在水中的溶解度曲线如图丙所示。

请填空:
(1)从t 1℃到t 2℃的变化过程中,一直处于饱和状态的是 (填"a"或"b")的溶液。
(2)图丙中曲线M表示的是 (填"a"或"b")的溶解度曲线。
(3)若a中混有少量的b,可采用 结晶的方法提纯a。
根据下表回答问题:
温度/℃ |
10 |
20 |
30 |
40 |
50 |
60 |
|
溶解度 /g |
NaCl |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
NH4Cl |
33.5 |
37.2 |
41.4 |
45.8 |
50.4 |
55.2 |
|
(1)海水中含有大量的氯化钠,海水晒盐的原理是 ,氨碱法制纯碱先向饱和食盐水中通入氨气,通入氨气的作用是 ,可向滤出晶体后的NaHCO3溶液中加入 以回收氨,使之循环使用。
(2)氯化钠和氯化铵具有相同溶解度的温度范围在 ℃之间。
(3)图中,A是60℃时含有120g水的NH4Cl溶液,经过如下操作后,得到固体。

I.C中溶液的质量是 g.A溶液为NH4Cl的 (选填“饱和”或“不饱和”)溶液,该溶液中溶质的质量分数为 (结果精确到0.1%)。
II.对以上过程的分析,正确的是 (选填编号)。
①A到B的过程中,溶质质量没有改变
②B中溶质与溶剂的质量比为55.2:100
③由B到C开始析出NH4Cl固体的温度在40℃至50℃之间。
根据下表回答问题:
温度/℃ |
10 |
20 |
30 |
40 |
50 |
60 |
|
溶解度 /g |
NaCl |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
NH4Cl |
33.5 |
37.2 |
41.4 |
45.8 |
50.4 |
55.2 |
|
(1)海水中含有大量的氯化钠,海水晒盐的原理是 ,氨碱法制纯碱先向饱和食盐水中通入氨气,通入氨气的作用是 ,可向滤出晶体后的NaHCO3溶液中加入 以回收氨,使之循环使用。
(2)氯化钠和氯化铵具有相同溶解度的温度范围在 ℃之间。
(3)图中,A是60℃时含有120g水的NH4Cl溶液,经过如下操作后,得到固体。

I.C中溶液的质量是 g.A溶液为NH4Cl的 (选填“饱和”或“不饱和”)溶液,该溶液中溶质的质量分数为 (结果精确到0.1%)。
II.对以上过程的分析,正确的是 (选填编号)。
①A到B的过程中,溶质质量没有改变
②B中溶质与溶剂的质量比为55.2:100
③由B到C开始析出NH4Cl固体的温度在40℃至50℃之间。
下列有关水和溶液的说法正确的是( )
A.用洗涤剂清洗油污是溶解作用
B.NaCl的饱和溶液不能再溶解KNO3
C.NaOH溶于水会使溶液温度升高
D.河水经过沉降、过滤、吸附后得到的水是纯净物
甲、乙试管中各盛有10.0g水,向其中一支试管中加入3.0gNa 2CO 3粉末,另一支试管中加入3.0g NaCl粉末,按图1、2进行实验,下列说法正确的是( )

| A. |
甲中加入的粉末是Na 2CO 3 |
| B. |
0℃时,甲中溶液一定不饱和,乙中溶液一定饱和 |
| C. |
Na 2CO 3中含有少量NaCl,可用冷却热饱和溶液的方法提纯Na 2CO 3 |
| D. |
30℃时,若使图1中甲、乙试管内的溶液恰好变为相应饱和溶液,甲中加入对应的溶质质量大于乙中加入对应的溶质质量 |
硝酸钾是实验室常见的一种试剂。
(1)硝酸钾是由 和 构成的(填写微粒符号)。
(2)硝酸钾中钾元素的质量分数是 (结果用百分数表示,保留到0.1%)。
(3)如图是硝酸钾的溶解度曲线,由图可以总结出硝酸钾的溶解度随温度变化的趋势是 。60℃时110g硝酸钾溶于100g水中形成的溶液是 ( 选填“饱和“或“不饱和”)溶液,将此时配得的溶液降温至20℃,析出硝酸钾晶体的质量是 g。
(4)列式计算:用100g 10%的硝酸钾溶液配制5%的硝酸钾溶液。需要加水多少亳升?(水的密度为1.0g•mL﹣1)

化学概念之间在逻辑上存在并列、交叉和包含等关系。下列各图中概念之间关系正确的是( )
A.
B.
C.
D.
下列说法正确的是( )
A.明矾可以区分硬水和软水
B.利用汽油的乳化作用可以除去衣服上的油污
C.饱和溶液不一定比不饱和溶液含溶质多
D.均一、稳定的液体一定是溶液
物质世界的变化都遵循一定的规律。下列叙述中,不正确的是( )
A.水的天然循环是通过其三态变化实现的
B.一切化学变化都遵循质量守恒定律
C.物质发生化学变化时伴随着能量变化
D.某温度下的饱和溶液不能再溶解任何物质
化学是造福人类的科学,请利用所学知识回答下列问题。
(1)新型材料有着广泛的应用。
应用 |
“蛟龙”号深潜器 |
“神舟”五号宇航员航天服 |
新型水处理剂 |
用到的材料 |
特种钢 |
高强度涤纶 |
纳米铁粉 |
①上述材料中属于有机合成材料的是 。
②纳米铁粉能吸附废水中的某些污染物,被吸附后的废水经沉降、过滤可去除污染物。
下列物质也能因吸附而具有净水作用的是 (填字母)
a.生石灰 b.活性炭 c.纯碱
(2)溶液与人们的生产生活密切相关,图I为甲、乙、丙三种固体物质的溶解度曲线。
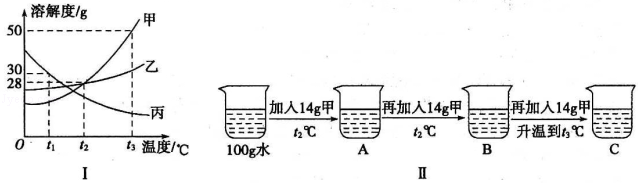
①t1℃时甲、乙、丙三种物质的溶解度由大到小的顺序是 。
②某同学按图Ⅱ所示进行实验,得到相应温度下的A、B、C三种溶液,其中属于饱和溶液的是 (填字母)。
③t3℃时向盛有40g甲物质的烧杯中加入50g水充分溶解后,所得溶液溶质的质量分数为 。(结果精确到0.1%)
如图是X、Y两种固体物质的溶解度曲线。下列叙述正确的是( )

A.温度低于t2℃时,物质Y的溶解度小于X
B.X、Y的溶解度都随温度升高而增大
C.a点表示t1℃时X、Y的溶液都不饱和
D.Y的饱和溶液降低温度后,溶质质量分数不变
溶液对于自然界中的生命活动和人类生产活动具有重要的意义,多角度认识溶液有助于指导我们的生活。
(1)关于溶液的说法,正确的是 (填写标号)
A.溶液中各部分的性质相同B.均一、稳定的液体一定是溶液
C.浓溶液不一定是饱和溶液D.溶液加水稀释后溶质的质量变小
(2)表Ⅰ是部分物质在20℃时的溶解性;表Ⅱ是氯化钠、碳酸钠在不同温度时的溶解度。
离子 |
OH﹣ |
Cl﹣ |
CO32﹣ |
SO42﹣ |
K+ |
溶 |
溶 |
溶 |
溶 |
Mg2+ |
不 |
溶 |
微 |
溶 |
Ba2+ |
溶 |
溶 |
不 |
不 |
表Ⅰ空格中应填写 ;分析表Ⅱ可知,氯化钠和碳酸钠的饱和溶液溶质质量分数相同时的温度是 。
温度 (℃) |
0 |
10 |
20 |
30 |
40 |
氯化钠(g) |
35 |
35.5 |
36 |
36.5 |
37 |
碳酸钠(g) |
6 |
10 |
18 |
36.5 |
50 |
(3)简单解释“夏天晒盐、冬天捞碱”的科学原理 。
在20℃时,某固体物质(不含结晶水)的水溶液,经历如图变化( )
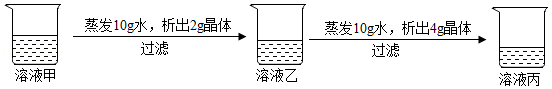
下列说法你认为正确的( )
A.溶液甲是饱和溶液
B.20℃时,该固体物质的溶解度是40g
C.溶液丙若蒸发10g水,析出的晶体一定大于4g
D.溶液乙溶质的质量分数小于溶液丙溶质的质量分数
如图是a、b、c三种固体物质的溶解度曲线,下列说法正确的是( )

A.a属于易溶性物质
B.t℃时c物质的饱和溶液,可采用升高温度方法使其变为不饱和溶液
C.90℃时,将50ga物质加入到50g水中充分搅拌,可得到100ga的饱和溶液
D.将20℃时三种物质的饱和溶液升温到90℃,所得溶液中溶质的质量分数的大小关系是:a>c>b
试题篮
()