如图是不含结晶水的a、b、c 三种物质的溶解度曲线,下列说法正确的是( )

| A. |
t 2℃时,将50g a物质加入到50g 水中充分搅拌,得到100g a的饱和溶液 |
| B. |
用等质量的a、b、c 三种固体配制成t 2℃时的饱和溶液,所得溶液质量的大小关系是:c溶液>b溶液>a溶液 |
| C. |
将t 1℃时三种物质的饱和溶液升温到t 2℃时,所得溶液M中溶质的质量分数的大小关系是:b>a=c |
| D. |
将t 2℃时a、b 两种物质的饱和溶液降温到t 1℃时,析出晶体的质量:a>b |
熟石灰的溶解度曲线如图所示。下列有关说法不正确的是( )

A.30℃时,熟石灰饱和溶液中溶质的质量分数为15%
B.将30℃的熟石灰饱和溶液升温至75℃(溶剂的量不变),溶液中会出现浑浊
C.50℃时,要使接近饱和的熟石灰溶液达到饱和状态,可用蒸发溶剂的方法
D.将熟石灰饱和溶液从80℃降温至20℃,一定没有氢氧化钙析出
如图是三种固体物质的溶解度曲线,下列说法正确的是( )

| A. |
物质c的溶解度随温度的升高而增大 |
| B. |
物质a的溶解度大于物质c的溶解度 |
| C. |
t 2℃时,60g物质a与100g水充分混合后所得溶液的总质量为160g |
| D. |
将t 1℃b,c两种物质的饱和溶液升温至t 2℃,溶液中溶质质量分数不变的是b的溶液 |
20℃时,将不同质量的NaCl晶体分别加入100g水中,充分溶解后所得溶液质量与加入NaCl晶体质量的对应关系如表:
| 组别 物质质量 |
A |
B |
C |
D |
E |
| NaCl晶体质量/g |
5 |
15 |
20 |
30 |
40 |
| 所得溶液质量/g |
105 |
115 |
X |
130 |
136 |
请回答下列问题:
(1)A组的溶液为 (填"饱和"或"不饱和")溶液。
(2)C组X的值为 。
(3)如图为NaCl的溶解度曲线图,图上a点纵坐标的值为 。Ca(OH) 2的溶解度温度变化的趋势与NaCl相反,则室温时,向饱和石灰水加入少量生石灰,并恢复到室温,此时溶液中溶质的质量 (填">"、"<"或"=")原溶液中溶质的质量。

如图是甲、乙、丙三种固体物质的溶解度曲线。下列叙述正确的是( )

1℃时,等质量的甲、乙溶液中所含溶质的质量为乙>甲
2℃时,20g丙能溶解于50g水中形成70g溶液
C.若要将N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法
32℃,所得溶液溶质质量分数的大小关系为乙>甲>丙
甲、乙、丙三种固体物质的溶解度曲线如图所示,下列分析错误的是( )

1℃时,甲、乙、丙三种物质的溶解度大小关系是 丙>乙>甲
B.含有甲、乙、丙三种物质的混合溶液恒温蒸发时首先析出乙,说明在此温度下乙的溶解度最小
32℃,所得溶液的质量分数关系是丙>甲=乙
D.若固体甲中混有少量乙,可采用降温结晶法提纯甲
如图是甲、乙、丙三种物质的溶解度曲线,下列叙述正确的是( )

1℃时,等质量的甲、丙溶液中所含溶质的质量分数为丙>甲
2℃时,20g丙溶解于50g水中能形成70g溶液
32℃时,所得溶液溶质质量分数的大小关系为乙>甲=丙
D.若要将组成在N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法
A、B、C三种固体物质的溶解度曲线如图所示,回答下列问题.
1℃时,A、B、C三种物质的溶解度由大到小的顺序是 .
2℃时,在A物质的饱和溶液中溶质与溶剂的质量最简比为 .
3℃时,100g水中溶解60g B刚好饱和,那么50g 水中溶解 g C也刚好达饱和.
(4)当A中混有少量B时,可用 (填“降温结晶”或“蒸发结晶”)方法提纯A.

甲、乙两种固体物质的溶解度曲线如图所示,下列说法正确的是( )

| A. |
20℃时,甲物质的溶解度是40 |
| B. |
升温可使乙物质的饱和溶液析出固体 |
| C. |
甲物质的溶解度大于乙物质的溶解度 |
| D. |
40℃时,将甲、乙两物质饱和溶液分别降温到20℃,二者都变为不饱和溶液 |
硝酸钾常用于配制无土栽培的营养液,如图是KNO 3的溶解度曲线,请回答相关问题:
(1)T 1℃时,称量6.0g KNO 3,加入20g水,固体全部溶解,所得溶液的溶质质量分数为 ,该溶液为 (填"饱和"或"不饱和")溶液.
(2) 将上述溶液由T 1℃加热至T 2℃(忽略水的蒸发),有关溶液的变化描述正确的是 (填序号).
a.变为饱和溶液 b.变为不饱和溶液
c.溶质质量分数增大 d.溶质质量分数不变
(3)某同学在T 1℃时,称量6.0gKNO 3,加入20g水,搅拌却发现烧杯中仍有少量固体不溶,该现象可能是下列哪些操作引起的 (填序号).
a.用量筒量取20mL水时俯视读数 b.用量筒量取20mL水时仰视读数
c.称量KNO 3时将砝码放在左盘(1g以下用游码) d.向烧杯中倾倒水时,有水溅出
(4)请写出一种能使(3)中固体全部溶解的措施 .

如图是氯化钠、氯化铵和碳酸氢钠三种物质的溶解度曲线,分析曲线得到的以下说法中,正确的是( )
①氯化钠和氯化铵是易溶物质,碳酸氢钠是可溶物质
②在20℃时,三种物质饱和溶液的溶质质量分数为NH 4Cl>NaCl>NaHCO 3
③在30℃时,氯化钠和氯化铵固体各20g分别溶于50g水,所得溶液都是饱和溶液
④利用结晶法从氯化钠、氯化铵混合物中分离出氯化铵的最佳温度在10℃以下.
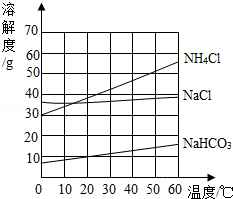
| A. |
①②③ |
B. |
①②④ |
C. |
②③④ |
D. |
①③④ |
如图为甲、乙两物质(均不含结晶水)的溶解度曲线,下列说法正确的是( )

| A. |
20℃时,100g甲溶液中含甲物质的质量为25g |
| B. |
20℃时,等质量甲、乙饱和溶液中含溶质的质量相等 |
| C. |
将甲物质从50℃降温到30℃时一定有晶体析出 |
| D. |
将甲、乙两种物质的溶液分别从50℃降温至20℃时,溶液中溶质质量分数均为25% |
图1是三种常见物质的溶解度曲线.请回答以下问题.

(1)由图1可知,30℃时硝酸钾的溶解度是 g.
(2)图1所示三种物质中溶解度随温度升高而减小的物质是 (填名称).
(3)若氯化钠固体中混有少量硝酸钾、提纯氯化钠的方法是 (选填"降温结晶"、"蒸发结晶").
(4)现有40℃时等质量的硝酸钾、氯化钠饱和溶液,加热蒸发等质量的水后恢复至40℃,剩余溶液的质量关系大小为硝酸钾 氯化钠(选填">"、"="或"<").
(5)若a、b、c分别代表上述三种物质,图2是在室温下,烧杯中a物质的溶液、试管①中b物质的溶液和试管②中c物质的溶液的状态.当从室温升至60℃时,发现烧杯中a物质没有明显变化,试管①中b物质全部溶解,试管②中有c物质析出,写出a、b、c三种物质的化学式:a ,b ,c .
甲、乙两种固体物质的溶解度曲线如图所示。下列叙述中正确的是( )

A.甲物质的溶解度大于乙物质的溶解度
1℃时,甲、乙两物质饱和溶液的溶质质量分数一定相等
2℃时,将30g甲物质放入70g水中,所得饱和溶液的质量为100g
21℃,析出晶体质量甲>乙
试题篮
()