水和溶液在生产,生活中具有广泛的用途。
(1)下列物质属于溶液的是 (填字母)。
A.医用酒精
B.植物油和水的混合物
C.蒸馏水
D.糖水和食盐水的混合物
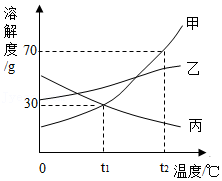
(2)甲、乙两种不含结晶水的固体物质的溶解度曲线如图所示。

①t1℃时,甲物质的溶解度是 。
②t2℃时,分别将甲、乙固体溶于水,配成两种物质的饱和溶液各100g,所需水的质量相比,甲 乙(填“大于”“小于”或“等于”)。
(3)如图中甲、乙、丙、丁、戊是五种不同类别的物质,且分别属于单质、氧化物、酸、碱盐中的一种。相连物质之间均能在一定条件下发生化学反应,且生成物之一为水。

①当丁为氢氧化钠、戊为氯化铵时,甲、乙、丙的化学式依次可能是 (只写一组),其中丙和丁发生中和反应的化学方程式为 ;乙和丙反应的化学方程式为 。
②若要鉴别氯化铵和氯化钾固体,通常可采用的方法是 。
(4)中国天宫空间站预计2022年建成。空间站获取氧气的主要方式是电解水,写出电解水的化学方程式 ,并计算若得到16kg的氧气,理论上最少消耗水的质量是多少?
结合KNO 3和NH 4Cl的溶解度曲线判断,下列叙述错误的是( )

| A. |
t 1℃时,两种物质的溶解度相等 |
| B. |
两种物质的溶解度都随温度升高而增大 |
| C. |
升高温度可将接近饱和的KNO 3溶液变成饱和溶液 |
| D. |
将t 2℃的饱和NH 4Cl溶液降温到t 1℃,溶液质量减小 |
甲、乙、丙三种固体物质的溶解度曲线如图所示。下列说法正确的是( )

| A. |
10℃时,甲的溶解度最大 |
| B. |
图中P点表示10℃时丙的饱和溶液 |
| C. |
20℃时,向130g乙的饱和溶液中加入20g水,乙的质量分数变为20% |
| D. |
50℃时,同质量的甲、乙、丙饱和溶液降温至10℃,丙溶液中析出固体最多 |
从物质的溶解度曲线中,可以获得很多信息。甲、乙两种固体物质的溶解度曲线如图所示。
(1)t1℃时,甲、乙两种物质的溶解度 (填“相等”或“不相等”)
(2)两种物质中, 的溶解度受温度的影响较大。
(3)要使接近饱和的乙溶液变成饱和溶液,可采用的方法有 (写一种即可)。

甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答下列问题:
(1)t1℃时,丙物质的溶解度为 g。
(2)t2℃时,往盛有50g蒸馏水的烧杯中加入50g甲固体,充分溶解后所得溶液的质量为 g。
(3)除去甲中含有的少量丙,可采用的方法是 法(填“降温结晶”或“蒸发结晶”)。
(4)将t1℃时的甲、乙、丙三种物质的饱和溶液升温至t2℃,所得溶液溶质的质量分数由大到小的顺序为 。
如图是A、B、C三种固体物质的溶解度曲线,据图作答:
(1)P点的意义是 。
(2)A、B、C三种物质中,溶解度随着温度的上升而减小的物质是 。
(3)t2℃时,将30g A物质加入到50g水中可形成 g溶液,此时溶液是 (填“饱和”或“不饱和”)溶液。
(4)将t2℃时A、B、C三种物质的饱和溶液均降温至t1℃,所得溶液中溶质质量分数由大到小的顺序是 。
(5)A物质中混有少量的C物质,若提纯A物质,可采用的结晶方法是 。

如图所示为A、B、C三种物质(均不含结晶水)的溶解度曲线,回答下列问题:
(1)溶解度随温度升高而减小的物质是 。
(2)10℃时A、B、C溶解度由大到小的顺序是 。
(3)将40℃时等质量的A、B、C的饱和溶液分别降温至30℃,溶质质量分数不变的是 。
(4)将30℃时65g A的饱和溶液升温至40℃,若要使溶液重新达到饱和,至少应加入
g A。

如图是甲、乙、丙三种固体物质的溶解度曲线(变温时不考虑溶剂蒸发),下列说法错误的是( )

| A. |
t 1℃时,甲、丙的饱和溶液,溶剂质量可能相等 |
| B. |
t 3℃时,等质量的甲、乙、丙的溶液,溶质的质量可能相等 |
| C. |
将t 3℃时甲、乙、丙的混合溶液降温至t 1℃,析出的固体中可能只有乙 |
| D. |
将t 1℃时乙、丙的饱和溶液升温至t 2℃,两种溶液中溶质的质量分数可能相等 |
下列是MgSO 4和KCl的溶解度表及溶解度曲线。
| 温度/℃ |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
|
| 溶解度/g |
MgSO 4 |
33.7 |
38.9 |
44.5 |
50.6 |
54.6 |
55.8 |
52.9 |
52.2 |
| KCl |
34.0 |
37.0 |
40.0 |
42.6 |
45.5 |
48.3 |
51.1 |
54.0 |
|
请分析后回答下列问题:
(1)代表KCl溶解度曲线的是 (填"甲"或"乙")。
(2)t 2的范围为 (填字母)。
| A. |
50~60 |
| B. |
60~70 |
| C. |
70~80 |
| D. |
80~90 |
(3)将t 3℃时MgSO 4的饱和溶液降温到t 1℃,溶液中溶质的质量分数的变化情况是 (填字母)。
| A. |
始终不变 |
| B. |
先增大后减小 |
| C. |
先减小后增大 |
| D. |
先不变后减小 |
| E. |
先不变后增大 |

下表是氯化钠和硝酸钾在不同温度下的溶解度。
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
|
溶解度/g |
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
KNO3 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
|
请回答下列问题:
(1)30℃时,硝酸钾的溶解度为 。
(2)使硝酸钾饱和溶液变为不饱和溶液,可采用的一种方法是 。
(3)50℃时,将80.0g一定质量分数的氯化钠溶液恒温蒸发,溶液的质量随蒸发水的质量变化关系如图所示,则a点溶液中溶质的质量为 。
(4)下列有关说法正确的是 (填标号)。
A.与氯化钠相比,硝酸钾的溶解度受温度影响较大
B.除去硝酸钾中混有的氯化钠,可采用降温结晶的方法
C.20℃时,向40.0g质量分数为25%的氯化钠溶液中加入10.0g氯化钠,可得到40%的氯化钠溶液
D.40℃时,分别向氯化钠和硝酸钾的饱和溶液中加入等量的水,所得溶液的质量分数可能相等

如图为甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线图,请回答下列问题:
(1)当温度为 ℃时,甲乙两物质溶解度相等。
(2)在t2℃时,将30克甲物质加入到50克水中充分溶解,所得溶液质量为 克。
(3)在t2℃时,将等质量的甲、乙、丙的饱和溶液升温至t3℃时,所得的溶液质量由大到小的顺序 。

K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如图:
温度/℃ |
20 |
30 |
50 |
60 |
80 |
|
溶解度/g |
K2CO3 |
110 |
114 |
121 |
126 |
139 |
KNO3 |
31.6 |
45.8 |
85.5 |
110 |
169 |
|
(1)图1中能表示K2CO3溶解度曲线的是 (填“甲”或“乙”)。
(2)在20℃时,将20g的KNO3加入到50g的水中,充分搅拌,得到溶液的质量为 g。
(3)在t℃时,K2CO3饱和溶液的溶质质量分数(w1)和KNO3饱和溶液的溶质质量分数(w2)的大小关系:w1 w2(填“>”、“=”或“<”)。
(4)在不改变溶液质量的情况下,要使一定量接近饱和的KNO3溶液变为饱和溶液的方法是: 。

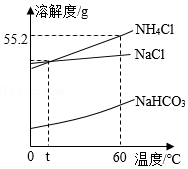
侯德榜先生发明了侯氏制碱法,主要原理及部分操作为:一定条件下,将NH 3、CO 2通入饱和氯化钠溶液,发生反应:NaCl+CO 2+H 2O+NH 3═NaHCO 3↓+NH 4Cl,过滤,滤液中主要含有NH 4Cl、NaCl两种物质,如图为NH 4Cl、NaCl、NaHCO 3三种物质的溶解度曲线。回答下列问题:
(1)60℃时,氯化铵的溶解度是 g。
(2)碳酸氢钠晶体首先从溶液中析出的原因是 。
(3)从滤液中得到氯化铵晶体的操作:蒸发浓缩、 、过滤、洗涤、干燥。
(4)将60℃时氯化铵和氯化钠的饱和溶液各100g分别蒸发掉10g水,然后降温至t℃,过滤,得到溶液甲和溶液乙,下列说法正确的是 (填标号)。
| A. |
甲和乙都是饱和溶液 |
| B. |
溶剂的质量:甲<乙 |
| C. |
溶液的质量:甲>乙 |
| D. |
溶质的质量分数:甲=乙 |
故填:ABD。
Ⅰ.溶液在生产、生活中起着十分重要的作用。请回答(1)﹣(2)题。
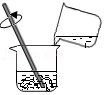
(1)如图,在木块上滴几滴水,将装有某种固体的大烧杯放置于木块上,向大烧杯中加水进搅拌,结果木块上的水结冰了,则大烧杯内的固体可能是 。
| A. |
氯化钠 |
B. |
硝酸铵 |
| C. |
氢氧化钠 |
D. |
蔗糖 |
(2)用汽油或加了洗涤剂的水都能除去衣服上的油污,两者去油污的原理分别是 。
| A. |
乳化、乳化 |
B. |
乳化、溶解 |
| C. |
溶解、乳化 |
D. |
溶解、溶解 |
Ⅱ.如图是甲、乙、丙三种固体物质的溶解度曲线。请回答(3)(4)题。
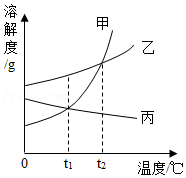
(3)现有t 1℃时甲乙、丙三种物质的饱和溶液,将这三种溶液分别升温到t 2℃,所得溶液中溶质质量分数大小关系是 。
| A. |
甲=乙>丙 |
B. |
乙>甲=丙 |
| C. |
乙>甲>丙 |
D. |
甲>乙>丙 |
(4)为了将近饱和的丙溶液变为饱和溶液,可采用的方法有 (有2﹣3个选项符合题意)。
| A. |
加固体丙 |
B. |
加水 |
| C. |
降低温度 |
D. |
蒸发浓缩 |
试题篮
()