硝酸钾的溶解度曲线如图所示。回答下列问题:
(1)30℃时,硝酸钾的溶解度是 g。
(2)60℃时,在100g水中加入60g硝酸钾固体,充分搅拌,所得溶液是 (填"饱和"或"不饱和")溶液。
(3)将(2)中所得的溶液从60℃降温至30℃,可析出硝酸钾晶体 g,此时溶液的溶质质量分数 45.8%(填">""<"或"=")。

a、b两种固体物质的溶解度曲线如图所示,据图回答:

(1)两种物质中,溶解度随温度升高而减小的是 。
(2)当温度为 ℃时,a和b的溶解度相等。
(3)t2℃时,由图2推测W是图1中的 物质。
如图是MgCl 2、KCl和MgSO 4的溶解度曲线。下列说法错误的是( )

| A. |
P点表示t 2℃时KCl和MgSO 4的溶解度相等 |
| B. |
t 1℃时三种物质的饱和溶液中,溶质质量分数最大的是MgCl 2 |
| C. |
将t 2℃时的三种物质的饱和溶液分别升温至t 3℃,会析出晶体的是MgSO 4 |
| D. |
t 2℃时,将40g MgCl 2加入50g水中充分搅拌,所得溶液质量为90g |
甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是( )

| A. |
甲的溶解度大于乙的溶解度 |
| B. |
t 2℃时甲、乙的饱和溶液中溶质的质量分数相等 |
| C. |
t 1℃时乙的饱和溶液降温析出固体后变为不饱和溶液 |
| D. |
将t 2℃时甲、乙的饱和溶液降温到t 1℃,甲析出固体的质量大 |
硝酸钾和氯化钾两种物质的溶解度曲线见图1,这两种物质的溶解度见表。
| 温度/℃ |
10 |
20 |
30 |
40 |
50 |
60 |
|
| 溶解度/g |
甲 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
| 乙 |
31.0 |
34.0 |
37.0 |
40.0 |
42.6 |
45.5 |
请回答下列问题:
(1)观察溶解度曲线和溶解度表,判断物质乙是指 (填写化学式)。
(2)60℃时,饱和KNO 3溶液中混有少量KCl,应采用 的方法提纯KNO 3(填写"蒸发溶剂"或"冷却结晶")。
(3)60℃时,分别将等质量的KNO 3和KCl两种物质的饱和溶液温度降至t℃,析出晶体的质量关系为:KNO 3 KCl(填写">""="或"<")。
(4)如图2所示,20℃时,将一定质量的KNO 3固体放入盛水的试管中,发现有少量固体未溶解,向烧杯的水中加入某物质后,试管内固体能完全溶解。则加入的物质可以是 (填写字母标号)。

①冰块 ②生石灰固体 ③硝酸铵固体 ④干冰 ⑤浓硫酸 ⑥氢氧化钠固体
A.①③④
B.②⑤⑥
C.①③⑤
D.②④⑥
(5)60℃时,将45g KCl固体溶解于100g水中,降温至20℃,析出晶体的质量是 。
水和溶液在生活、生产中应用广泛。请回答下列问题。
(1)水的天然循环既实现了水的自身净化,又完成了水资源的重新分配。水在天然循环过程中发生了 (选填"物理"或"化学")变化。
(2)对天然水进行净化处理,可以得到自来水,将自来水进一步净化处理得到可直接饮用的水。机场、车站等公共场所设有许多直饮水机,其处理水的过程如图所示。

图中①对应的作用是 (选填字母序号,下同),③对应的作用是 。
| A. |
杀菌消毒 |
| B. |
过滤 |
| C. |
吸附杂质 |
| D. |
蒸馏 |
(3)含有较多可溶性钙、镁矿物质的天然水称为硬水。生活中为了降低水的硬度并杀菌消毒,可采用的方法是 。
(4)溶液对于生命活动具有重要意义。某同学出现低血糖症状时,校医给他喝了一瓶质量为200g溶质质量分数为25%的葡萄糖水,快速补充糖分。这瓶葡萄糖水中溶质的质量为 g。
(5)如图是氯化钠和硝酸钾两种固体的溶解度曲线,据图分析:

①溶解度受温度影响较大的物质是 。
②若硝酸钾晶体中含有少量的氯化钠杂质,可采用 的方法提纯硝酸钾。
如图是甲、乙、丙三种固体物质的溶解度曲线。
(1)P点表示的含义为 。
(2)t1℃时,60g甲物质的饱和溶液升温到t2℃,再加 g甲物质,溶液仍然饱和。
(3)t2℃时,甲溶液中有少量丙,要提纯甲,用 结晶法。
(4)将t2℃时的甲、乙、丙的饱和溶液降温到t1℃,所得溶液中溶质的质量分数由大到小的顺序为 。

a、b是常见的两种固体物质,根据图表的信息回答下列问题:

物质b的溶解度表
| 温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
| b的溶解度/g |
14 |
20 |
30 |
45 |
65 |
85 |
110 |
(1)60℃时,物质a的溶解度是 g;
(2)20℃时,将20g物质b加入到50g水中,充分溶解后得到溶液的质量为 g;
(3)将50℃时a、b两物质的饱和溶液分别降温至20℃,所得溶液的溶质质量分数大小关系为a b(填">"、"="或者"<");
(4)下列说法正确的组合是 (填字母序号)。
①所有物质的溶解度都随温度的升高而增大
②30℃时,物质的溶解度a小于b
③物质b中含有少量a时,可以采用降温结晶的方法提纯b
④40℃时,分别将物质a、b的饱和溶液降温至10℃,析出物质的质量b大于a
A.①④B.①③C.②③D.②④
10℃时,将3g甲、乙两种可溶性固体分别放入盛有10mL水的试管中。两种物质的溶解情况(见图Ⅰ),两种物质的溶解度随温度的变化(见图Ⅱ)。下面对甲、乙两物质的判断,不正确的是( )

| A. |
10℃时,甲、乙两物质的溶液都是饱和溶液 |
| B. |
温度升高至25℃时,甲、乙两物质的溶液都是不饱和溶液 |
| C. |
甲物质对应的溶解度曲线为a |
| D. |
可用降温结晶法分离甲、乙两种物质的混合物 |
如图是甲乙两种物质的溶解度曲线。下列说法正确的是( )

A.甲的溶解度比乙的溶解度大
B.a2℃时,将30g甲放入50g水中充分搅拌可得80g溶液
C.a1℃时甲、乙两种物质的饱和溶液溶质的质量分数相同
D.将a1℃时甲、乙同种物质的饱和溶液升温至a2℃,溶质的质量分数都增大
溶液与人们的生产生活密切相关。
(1)下列常见物质不属于溶液的是 (填序号)。
A.生理盐水
B.糖水
C.医用酒精
D.牛奶
(2)如图是A物质的溶解度曲线,下表是B物质在不同温度时的溶解度。
| 温度/℃ |
B物质溶解度/g |
| 0 |
32 |
| 20 |
35 |
| 40 |
40 |
| 60 |
45 |
| 80 |
55 |
①60℃时,A物质的溶解度是 g。
②50℃时,向100g水中加入40g B物质,充分溶解后得到的是 (填"饱和"或"不饱和")溶液,此时溶液的溶质质量分数是 (结果保留两位小数)。
③请根据表格数据,在A物质溶解度曲线图上绘出B物质的溶解度曲线。
④A、B两种物质溶解度相同时的温度是 ℃。
(3)生活中常用75%酒精消毒液对手和皮肤进行消毒。请分析酒精浓度与杀死细菌的时间对比表(如下)中的数据,酒精消毒液的最合适浓度应为 。根据酒精的物理性质,你认为两者浓度差异的主要原因是 。
| 酒精浓度(%) |
大肠杆菌 |
金黄色葡萄球菌 |
溶血性链球菌 |
| 90 |
15小时 |
30分钟 |
5分钟 |
| 80 |
1小时 |
30分钟 |
5分钟 |
| 70 |
30秒 |
5分钟 |
10秒 |
| 60 |
20秒 |
30分钟 |
10秒 |
| 50 |
20秒 |
2小时 |
20秒 |
| 40 |
22分钟 |
4小时 |
2分钟 |
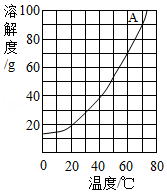
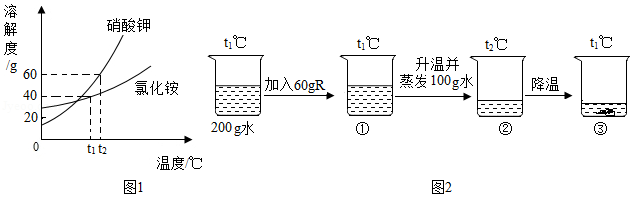
硝酸钾和氯化铵的溶解度曲线如图1所示。某化学兴趣小组的同学进行了如图2所示实验,R是硝酸钾、氯化铵中的一种物质。
(1)硝酸钾和氯化铵两种物质的溶解度均随温度的升高而 。
(2)由图1可知:t 1℃时,氯化铵饱和溶液中溶质与溶液的质量比为 。
(3)结合图1和图2判断:烧杯内的物质R是 。①、②、③三种情况下,一定是饱和溶液的有 (填序号)。
请根据如图甲、乙、丙三种固体物质的溶解度曲线,回答下列问题。
(1)在 ℃时,甲、丙两种物质的溶解度相等;
(2)在t2℃时,向盛有25g甲物质的烧杯中加入50g水,充分溶解后,所得溶液的溶质质量分数为 。
(3)若乙物质中混有少量甲物质,最好采用 (填“降温结晶”或“蒸发结晶”)的方法提纯乙;
(4)t2℃时,甲、乙、丙三种物质的饱和溶液各100g,所含溶剂的质量由大到小的顺序是 。

甲、乙两种物质的溶解度曲线如图。
(1)A点的含义是 。
(2)t2℃时,甲、乙两种固体各8g分别投入25g水中,充分搅拌。
① (填“甲”或“乙”)所得溶液为不饱和溶液,若保持温度不变,加入溶质 g可使其达到饱和。
②乙所得溶液中溶质质量分数为 %。

试题篮
()