矿物资源的综合利用,可以节约资源与能源.黄铁矿的主要成分为二硫化亚铁(FeS 2),黄铁矿煅烧的化学方程式:4FeS 2+11O 2═2Fe 2O 3+8SO 2.产生的SO 2用于生产硫酸,矿渣(含有少量的硫元素)用于冶铁.
查阅资料:SO 2气体能使品红溶液褪色,能使澄清石灰水变浑浊,反应的化学方程式为SO 2+Ca(OH) 2═CaSO 3↓+H 2O.
(1)FeS 2中硫元素的化合价为 .矿渣在炼铁高炉内反应产生的高炉气含CO、CO 2、SO 2等气体,其中 是形成酸雨的气体.
(2)某化学兴趣小组为检验高炉气中的CO、CO 2、SO 2,设计了如图所示装置(不考虑其他气体对该实验的影响).
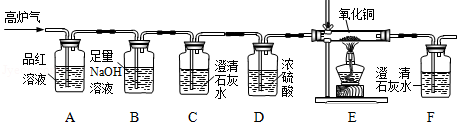
①该装置不能检验出的气体是 .
②装置B的作用是 .
③装置E中发生反应的化学方程式为 .
④确认高炉气中含CO的依据是 (填小写字母).
a.装置C中澄清石灰水变浑浊 b.装置C中澄清石灰水不变浑浊
c.装置E中黑色粉末变成红色 d.装置F中澄清石灰水变浑浊
(3)请指出该装置存在的一处明显缺陷 .
世界上每年都有将近总产量十分之一的钢铁锈蚀,造成了巨大的经济损失。为探究铁锈蚀的原因,分别取3枚洁净无锈的铁钉放入试管中,进行如下实验:

(1)进行实验一时,老师指导同学们先向迅速冷却后的沸水中,放入一截打磨光亮的略长于铁钉的镁带,几分钟后再放入铁钉。镁带的作用是 。
(2)大多数同学都观察到了实验一、实验二中铁钉无锈,实验三中铁钉生锈的现象,得出铁生锈的条件是 。某同学却发现本组实验二中的铁钉表面出现了少量铁锈,经仔细检查后发现胶塞已塞紧,产生这种现象的原因可能是 。
(3)工业上用锈蚀的废旧铁制品可以回炉炼铁,原理是 (用化学方程式表示)。在生活中人们对废旧金属合理的处理方法通常有 (写一种)。
早在春秋战国时期,我国就开始生产和使用铁器。
(1)用赤铁矿(主要成分是Fe2O3)冶炼生铁的化学方程式为 。
(2)用铁锅炒菜是利用铁的 性,用生铁制铁锅而不用纯铁的主要原因是 ,铁锅与 接触时容易锈蚀,防止铁锅锈蚀的一种方法是 。
近年来,共享单车在国内一些城市走红.

(1)图1共享单车上标出的部件由有机合成材料制成的是 (填序号);
(2)保护共享单车的措施之一是防止其锈蚀,其中链条常采用的防锈方法是 ,防锈的原理是 .
(3)共享单车中有些部件是由钢铁制成的,图2是工业炼铁的反应原理模拟实验,玻璃管中发生反应的化学方程式是 ;从环保角度看,该装置的不足之处是 .
金属材料是重要的资源,在日常生活中已经得到越来越广泛的应用。
(1)将铝片和硬铝片相互刻画,铝片上留下明显的划痕,说明 。
(2)沙漠地区的铁制品锈蚀较慢,其原因是 。
(3)为了比较铁、铜、银三种金属的活动性顺序强弱,某同学设计了下列四种方案:
①将铁丝、银丝分别浸入硫酸铜溶液中;②将银丝分别浸入到硫酸亚铁、硫酸铜溶液中;
③将铜丝、银丝分别浸入到硫酸亚铁溶液中;④将铜丝分别浸入到硫酸亚铁、硝酸银溶液中其中可行的方案是 (填序号)。可行方案中发生的基本反应类型为 。
(4)工业上将赤铁矿石冶炼成铁是一个复杂的过程。炼铁高炉中发生的主要反应有:
①高温下一氧化碳将铁矿石还原为铁;②高温煅烧石灰石;③灼热的焦炭和二氧化碳的反应;④焦炭充分燃烧,其中体现焦炭作用的反应是 (填序号)。
试题篮
()