如图是某实验小组做粗盐提纯实验的部分操作示意图。下列有关实验叙述错误的是( )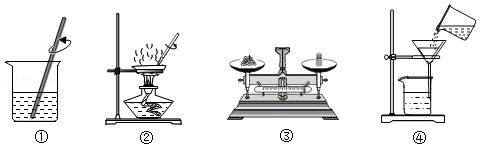
A.④中缺少玻璃棒引流溶液
B.①中玻璃棒的作用是搅拌,加速粗盐溶解
C.上述操作顺序为③①②④
D.当②蒸发皿中出现较多固体时,停止加热
化学是一门以实验为基础的科学,通过实验可以发现和验证化学原理,获得新的化学知识。请回答下列与化学实验有关的问题:
(1)利用课本实验测定空气里氧气的含量。得到氧气的含量小于 ,可能的原因是: 。(写一种即可)
(2)证明铜和铁金属活动性强弱的实验方法是: 。(写一种即可)
(3)在粗盐提纯实验的步骤中多处用到了玻璃棒,写出其中玻璃棒的作用 。(写一种即可)
有关“粗盐中难溶性杂质的去除”实验中说法不正确的是( )
A.多加水,让粗盐加速溶解
B.玻璃棒用了4次,但作用各不相同
C.粗盐经过溶解、过滤、蒸发、结晶可以得到初步提纯
D.当蒸发皿中出现较多量固体时,停止加热,利用余热使滤液蒸干
粗盐中除了含有NaCl外,还含有少量Na2SO4、CaCl2、MgCl2及泥沙等杂质。如图是常用的粗盐精制操作流程:
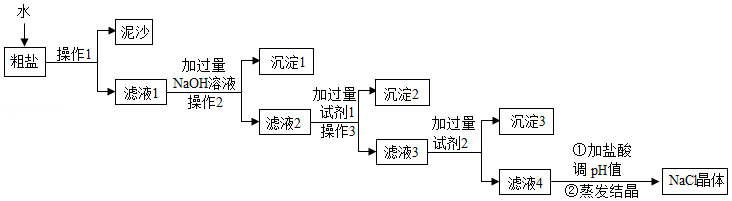
回答下列问题:
(1)操作1相当于实验室中的 操作;
(2)沉淀1的化学式为 ;
(3)加入过量试剂1的目的是 ;
(4)滤液4中含有的阴离子是 (填离子符号)。
酸、碱、盐种类繁多,与人类日常生活和工农业生产关系十分密切。
(1)酸具有相似的性质,因为不同的酸在水溶液中都能解离出 (填字母)。
a.H2O b.H2 c.H+ d.OH﹣
(2)检验敞口放置的氢氧化钠溶液是否变质,可以选用的一种试剂是 。
(3)利用数字化实验设备,测定盐酸与氢氧化钠溶液反应时溶液pH变化,实验结果如图1,当滴入溶液为V2mL时,所得溶液中溶质的化学式为 ,所得溶液能使紫色石蕊溶液变成 色。
(4)氯化钠是生活中常见的盐。为除去某粗盐水中的MgSO4、CaCl2杂质,得到NaCl溶液,某化学小组设计了如图2实验方案:
①过滤操作中所用到的玻璃仪器有烧杯、漏斗和 。
②以上方案中有关反应的化学方程式为 (写一个即可)。
③写出溶液乙中含有的杂质,并将以上方案补充完整
。
(5)某实验室用20%的NaOH溶液洗涤一定量石油产品中残余的H2SO4,消耗NaOH溶液40g,洗涤后的溶液呈中性,请计算该一定量石油产品中H2SO4的质量。
酸碱盐在工农业生产和生活中应用广泛,请用所学化学知识回答问题。
(1)日常生活中有以下常见物质:白醋、纯碱、苛性钠、小苏打、硫酸铵,其中属于碱的是 (填上述物质)。将少量无色酚酞溶液滴加到碱溶液中,溶液变 。
(2)如饮食不当,胃会分泌出大量胃酸,服用含有下列哪种物质的药物可以中和过多胃酸,写出反应的化学方程式 。
A.NaOH B.Na2CO3 C.Al(OH)3
(3)某氯化钠样品中,可能含有杂质:BaCl2、MgCl2、Na2SO4中的一种或几种,某校课外化学兴趣小组的同学进行实验探究杂质成分,探究过程如图(已知氢氧化镁难溶于水):

根据以上实验信息,用 操作方法,可将上述实验过程中产生的白色沉淀与溶液分离,加入适量NaOH溶液的目的是 ,写出杂质与Na2SO4溶液反应的化学方程式 。
某同学为除去食盐水中的Na2SO4杂质,进行了以下实验:
下列有关说法错误的是( )
A.X为BaCl2溶液B.Y为Na2CO3
C.Z为稀盐酸D.步骤②与④可交换
现有一包粗盐,其中含有少量氯化镁、硫酸钠和不溶性的泥沙。为获取纯净氯化钠,设计如图实验方案:

阴离子 阳离子 |
OH﹣ |
Cl﹣ |
SO42﹣ |
CO32﹣ |
H+ |
溶、挥 |
溶 |
溶、挥 |
|
Na+ |
溶 |
溶 |
溶 |
溶 |
Ba2+ |
溶 |
溶 |
不 |
不 |
Mg2+ |
不 |
溶 |
溶 |
微 |
根据上述有关信息回答下列问题:
(1)滤渣1是 。
(2)向滤液1中加入过量NaOH溶液发生反应的化学方程式是 。
(3)滤液2中的溶质除NaCl外还有 (填化学式)。
(4)若④加入的盐酸不慎过量,对氯化钠的纯度 (填“有”或“无”)影响,理由是 。
除去食盐溶液中的Na2SO4和CaCl2杂质的操作有:①加入过量BaCl2溶液;②过滤;③加入适量盐酸;④蒸发结晶;⑤加入过量Na2CO3溶液。
正确的操作顺序是( )
A.①⑤②③④B.③①⑤②④C.①③⑤④②D.⑤③②①④
如图是利用海水提取氯化钠的过程:

(1)图中①是 (“结晶”或“吸附”)池。
(2)粗盐中含有不溶性的泥沙和少量可溶性的CaCl2、MgCl2、Na2SO4;将样品加适量水溶解,然后进行 ,除去泥沙等不溶性杂质。
(3)向所得溶液中依次加入稍过量的BaCl2溶液、NaOH溶液和Na2CO3溶液除去生成的沉淀后,再滴加稍过量的稀盐酸,得到较纯净的NaCl溶液。加入稍过量稀盐酸的目的是 。
(4)蒸发溶剂,得到纯净氯化钠固体。
规范操作是实验成功的前提。请按要求回答下列问题:
(1)“粗盐中难溶性杂质的去除”实验中,玻璃棒的作用有:转移、 。
(2)“一定溶质质量分数溶液的配制”实验的基本步骤包括:计算、 、装瓶保存。
(3)利用pH试纸检验溶液的酸碱性,正确的操作应是 。
粗盐中常含有MgCl2、CaCl2、Na2SO4及泥沙等杂质,常用下面的流程进行提纯。下列说法正确的是( )
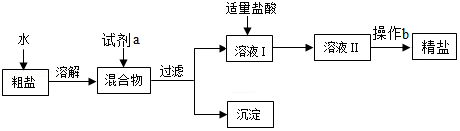
A.加入试剂a的顺序可以是过量的NaOH溶液、Na2CO3溶液,BaCl2溶液
B.加入试剂a后,将混合物过滤,得到的沉淀中除泥沙外还含有3种不溶物
C.向溶液Ⅰ中加入的盐酸也可以是过量的
D.操作b的名称为过滤
盐城濒临黄海,拥有巨大的天然宝库。
(1)海堤树林茂密,让人清新呼吸。
①树林中的绿色植物通过光合作用,吸收 (填化学式),放出O2,将 能转化为化学能。
②树林中富含抗氧化防衰老的负氧离子。一种负氧离子(O2﹣)的一个原子团是由一个O2分子俘获了空气中一个自由电子形成的微粒,每个O2﹣中共含有 个电子。
(2)滩涂花海飘香,使人流连忘返。
①鲜花的香味在空气中扩散,是大量的带有香味的分子 的结果。
②培育鲜花的某种营养液呈蓝色,可能由KNO3、Ca(NO3)2、CuCl2中的一种或几种物质配制而成,其中Ca、N的元素质量比为1:1,则该营养液中含有 种溶质。从均衡植物所需营养元素的角度分析,营养液中还需补充 (填元素符号)。
(3)大海资源丰富,引人不断探索。
从海水中可以提取粗盐(含少量泥沙和CaCl2、MgSO4等可溶性杂质)。小明利用如图流程进行除杂,得到精盐。
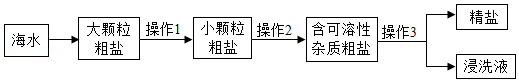
①操作1需要在 (填字母序号)中进行。
A.研钵 B.量筒 C.烧杯 D.广口瓶
②操作2的步骤为溶解、过滤、 、结晶,过滤操作中玻璃棒的作用是 。
③操作3的步骤为“盐洗”(即用NaCl溶液浸洗粗盐,以溶解除去其中可溶性杂质),过滤、烘干,则“盐洗”溶液应选用NaCl的 (填“饱和”或“不饱和”)溶液。
④在农业生产上,常用质量分数为16%的NaCl溶液选种。小明称取实验制得的精盐l6g,加入盛有84mL蒸馏水的烧杯里(实验条件下,水的密度为1g•mL﹣1),完全溶解。配制所得的NaCl溶液的浓度低于16%,原因是 。
⑤若利用化学方法除去粗盐中CaCl2、MgSO4两种杂质,可在粗盐溶液中依次加入稍过量的三种溶液:BaCl2溶液、 (填化学式)溶液、Na2CO3溶液。允分反应后过滤,加入过量稀盐酸,搅拌、煮沸。
请回答下列实验问题:
(1)现提供下列装置:

①如图E装置中,甲仪器的名称是 。
②实验室用KClO3和MnO2混合制O2,发生装置可选用 (填装置序号),用装置C干燥O2,气体由导管 端(填“a”或“b”)进入,用E装置收集O2的依据是 。
③英国化学家布莱克是第一个“捕捉”到CO2的人,实验室制备CO2的化学方程式为 ;1774年德国化学家贝格曼将CO2通入紫色石蕊试液中,发现试液由紫色变为红色,此反应的化学方程式为 。
(2)对一定质量的粗盐(含泥沙)进行初步提纯。
①实验的主要步骤:称量与溶解、过滤、蒸发;蒸发结束后用 (填仪器名称)将固体从蒸发皿转移到纸片上,比较食盐提纯前后的状态。
②下列有关蒸发过程说法正确的是 (填序号)。
a.蒸发时用玻璃棒不断搅拌
b.当蒸发皿中水分全部蒸干时,停止加热
c.蒸发时若有滤液溅出,则精盐质量将偏低
d.蒸发过程中,溶液中钠元素质量增大
我国海水晒盐的历史悠久。学习小组对粗盐进行提纯,并利用氯化钠进行实验探究。
Ⅰ.粗盐的提纯
粗盐中含有不溶性泥沙、可溶性CaCl2、MgCl2等杂质。学习小组设计了如下方案提纯粗盐: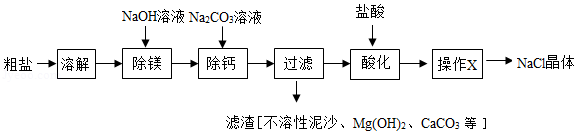
(1)用化学方程式表示Na2CO3溶液的作用: 。
(2)“过滤”中玻璃棒的作用为 ;“操作X”的名称为 。
Ⅱ.探究氨盐水与二氧化碳的反应
步骤1 取50mL浓氨水于锥形瓶中,加入NaCl晶体至不再溶解,制得氨盐水。
步骤2 向烧瓶中加入20mL氨盐水和约16g干冰,塞紧瓶盖,振荡、静置。一段时间后溶液中析出细小晶体,过滤、用冷水洗涤晶体并低温干燥。
【提出问题】晶体的成分是什么?
【实验探究1】①经甲同学检验,晶体中不含铵盐。甲同学的实验操作及现象是 。
②乙同学取晶体少许,加入稀硝酸,晶体溶解并产生无色气体,再滴加几滴AgNO3溶液,未见明显现象,说明晶体中不含有 离子。
【提出猜想】晶体的成分为Na2CO3或NaHCO3或两者的混合物。
【查阅资料】Na2CO3受热不分解;
NaHCO3受热易分解:2NaHCO3 Na2CO3+H2O+CO2↑。
【实验探究2】称取m1 g晶体,利用如图装置(夹持仪器略)探究晶体的成分。
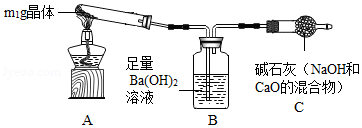
【实验现象】反应一段时间后,试管口凝结了少量小液滴,Ba(OH)2溶液变浑浊。
【实验分析】①晶体中一定含有 (填化学式)。
②将晶体加热至残留固体的质量不再改变,测得残留固体的质量为m2 g.若m1:m2= ,说明晶体为NaHCO3。
【拓展延伸】①氨盐水与二氧化碳反应所得铵盐的用途为 。
②丙同学认为通过测定装置B中沉淀的质量,经计算分析也可确定晶体的组成。请对丙同学的观点进行评价: 。
试题篮
()