某兴趣小组查阅资料发现除去泥沙等杂质的粗盐,可能还含有CaCl2、MgCl2、Na2SO4等杂质。他们将该粗盐配成溶液,并对粗盐溶液进行探究和除杂。
(1)配制溶液时,加速粗盐溶解的玻璃仪器是 。
【探究过程】
(2)步骤1:向粗盐溶液中加入过量NaOH溶液,未出现明显现象,说明溶液中无
杂质;向溶液中继续滴加过量Na2CO3溶液,产生白色沉淀CaCO3固体。反应的化学方程式为 。
(3)步骤2:向步骤1的滤液中滴加过量BaCl2溶液,产生白色沉淀,过滤;向滤液中滴加稀盐酸至溶液呈中性即得NaCl溶液。加稀盐酸除去的物质是 。
【初步结论】杂质成分已确定,且已完全除去。
【反思交流】
(4)小东认为Na2SO4还不能确定是否存在,可向步骤2的沉淀中滴加过量稀盐酸,若观察到 的现象,证明粗盐中确实存在Na2SO4。
(5)小红认为杂质也未完全除去,可按照步骤1和步骤2重新实验,并对调其中两种试剂的位置就能达到除杂目的,这两种试剂为 (填序号)。
A.Na2CO3溶液、BaCl2溶液
B.稀盐酸、BaCl2溶液
C.NaOH溶液、Na2CO3溶液
酸、碱、盐在生产和生活中有广泛的应用。
(1)焙制糕点所用发酵粉中含有碳酸氢钠,其俗名为 (填字母代号)。
a.纯碱 b.烧碱 c.苏打 d.小苏打
(2)如图1是氢氧化钠溶液与硫酸反应时溶液pH变化的示意图。
①根据图示判断,该实验是将 (填“氢氧化钠溶液”或“硫酸”)滴加到另一种溶液中。
②滴入溶液体积为V2mL时,溶液中的溶质为 。
(3)为除去粗盐水中的可溶性杂质MgSO4、CaCl2,某化学小组设计了如图2方案:

①过滤用到的玻璃仪器有烧杯、玻璃棒和 。
②写出加入Ba(OH)2溶液时反应的化学方程式 。(提示:微溶物不形成沉淀)
③溶液X中含有哪些杂质?请设计实验加以证明 。(简要写出实验步骤和现象)
(4)为测定某石灰石样品中碳酸钙的质量分数,称取10g石灰石(杂质不参加反应)放入烧杯中,加入100g稀盐酸,二者恰好完全反应,反应后烧杯中剩余物质的总质量为106.7g(气体的溶解忽略不计)。请计算该样品中碳酸钙的质量分数。
海水中蕴藏着丰富的资源,海水“晒盐”过程中可得到粗盐和卤水.粗盐中常含有多种杂质,必须对其分离和提纯,才能用于生产和生活;卤水经常用作工业制镁的原料.
(1)实验室除去粗盐中不溶性杂质的实验步骤为:溶解、过滤、蒸发结晶.在三步中都要用到的一种玻璃仪器是 .
2杂质,得到较为纯净的食盐晶体.请简述实验操作步骤: .
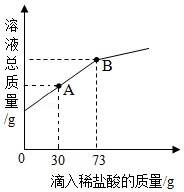
22的混合粉末6g,向其中加入20g水,经充分溶解后,再逐滴加入溶质质量分数为10%的稀盐酸.烧杯中溶液的溶液的总质量与加入稀盐酸的质量关系如图所示,请回答下列问题:
①当滴入稀盐酸30g时(即图中A点时),烧杯内溶液中的溶质是 (填写化学式).
②当滴入稀盐酸73g时(即图中B点时),试通过计算,求此温度时所得不饱和溶液中溶质的质量(计算结果精确至0.1g).
盐城盛产海盐,某化学兴趣小组同学在市场购到粗盐,带回实验室进行提纯。

(1)在溶解、过滤、蒸发等操作中,均用到的玻璃仪器是 (填仪器名称)。
(2)配制50g质量分数为6%的NaC1溶液,需称量NaCl固体 g,若用粗盐配制上述溶液,则所配溶液中NaC1的质量分数会 (填“偏大”、“偏小”或“无影响”)。
探究活动:以NaC1为原料可以制取金属钠。兴趣小组同学认为Na是活泼金属,能与CuSO4等盐溶液反应,生成相应的金属单质。
[提出问题]Na与CuSO4溶液反应,是否有Cu生成?
[设计实验]兴趣小组同学在老师的指导下,设计如图1装置进行实验。
Ⅰ.向大试管中加入一定体积煤油。
Ⅱ.用小刀切一小块钠,放入大试管,塞上橡皮塞。
Ⅲ.打开活塞,通过长颈漏斗向试管中加入CuSO4溶液,使煤油的液面升至胶塞,关闭活塞,观察现象。
[实验现象]
(1)Na在煤油与溶液交界处上下来回振动,表面产生气泡,逐渐变小直至消失。
(2)溶液颜色逐渐变淡,有蓝色絮状沉淀和少量黑色固体生成。
(3)打开活塞,用燃着的木条放在尖嘴管口处,气体被点燃。
[查阅资料]①Na通常存放在煤油中 ②煤油不溶于水且不与水反应
③2Na+2H2O=2NaOH+H2↑ ④Cu(OH)2 CuO+H2O
CuO+H2O
[实验分析]
(1)根据上述信息,可获知金属钠的物理性质是 (答出一点即可)。
(2)实验中长颈漏斗的作用 (填数字序号)。
①便于添加CuSO4溶液
②收集气体
③防止压强过大冲开活塞
(3)对于产生的气体,有些同学猜想是H2,有些同学猜想是SO2.小组同学经过讨论,排除了SO2,理由是 ,经过进一步实验,确认气体是H2。
(4)将反应后的混合物过滤,向滤渣滴加足量稀硫酸,滤渣完全溶解。写出滤渣与稀硫酸反应的化学方程式(写出一个即可) 。
[实验结论]Na与CuSO4溶液反应,无Cu生成。
[实验反思]Na与CuSO4溶液反应无Cu生成,原因可能是 。
[定量分析]另取一定量上述CuSO4溶液,完成下列实验。利用数据,计算无色溶液的溶质质量分数。(写出计算过程,滴入的酚酞溶液质量忽略不计。)
海水中蕴藏着丰富的资源,海水“晒盐”过程中可得到粗盐和卤水.粗盐中常含有多种杂质,必须对其分离和提纯,才能用于生产和生活;卤水经常用作工业制镁的原料.
(1)实验室除去粗盐中不溶性杂质的实验步骤为:溶解、过滤、蒸发结晶.在三步中都要用到的一种玻璃仪器是 .
(2)若要除去食盐固体中含有的少量CaCl2杂质,得到较为纯净的食盐晶体.请简述实验操作步骤: .
(3)在一烧杯中盛有Mg(OH)2和MgCl2的混合粉末6g,向其中加入20g水,经充分溶解后,再逐滴加入溶质质量分数为10%的稀盐酸.烧杯中溶液的溶液的总质量与加入稀盐酸的质量关系如图所示,请回答下列问题:
①当滴入稀盐酸30g时(即图中A点时),烧杯内溶液中的溶质是 (填写化学式).
②当滴入稀盐酸73g时(即图中B点时),试通过计算,求此温度时所得不饱和溶液中溶质的质量(计算结果精确至0.1g).

酸、碱、盐种类繁多,与人类日常生活和工农业生产关系十分密切。
(1)酸具有相似的性质,因为不同的酸在水溶液中都能解离出 (填字母)。
a.H2O b.H2 c.H+ d.OH﹣
(2)检验敞口放置的氢氧化钠溶液是否变质,可以选用的一种试剂是 。
(3)利用数字化实验设备,测定盐酸与氢氧化钠溶液反应时溶液pH变化,实验结果如图1,当滴入溶液为V2mL时,所得溶液中溶质的化学式为 ,所得溶液能使紫色石蕊溶液变成 色。
(4)氯化钠是生活中常见的盐。为除去某粗盐水中的MgSO4、CaCl2杂质,得到NaCl溶液,某化学小组设计了如图2实验方案:
①过滤操作中所用到的玻璃仪器有烧杯、漏斗和 。
②以上方案中有关反应的化学方程式为 (写一个即可)。
③写出溶液乙中含有的杂质,并将以上方案补充完整
。
(5)某实验室用20%的NaOH溶液洗涤一定量石油产品中残余的H2SO4,消耗NaOH溶液40g,洗涤后的溶液呈中性,请计算该一定量石油产品中H2SO4的质量。
粗盐中除了含有NaCl外,还含有少量Na2SO4、CaCl2、MgCl2及泥沙等杂质。如图是常用的粗盐精制操作流程:
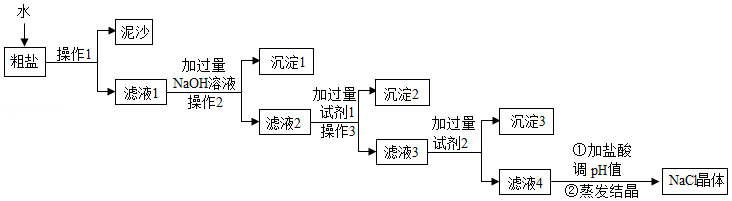
回答下列问题:
(1)操作1相当于实验室中的 操作;
(2)沉淀1的化学式为 ;
(3)加入过量试剂1的目的是 ;
(4)滤液4中含有的阴离子是 (填离子符号)。
如图为“去除粗盐中难溶性杂质并计算产率”的实验操作示意图:

(1)请将上述操作进行合理排序: (填序号)、计算;请改正操作④中的错误 ;
(2)操作②中,用玻璃棒不断搅拌的目的是 ;
(3)过滤后,如果滤液仍然浑浊,其原因可能是 ;
(4)通过以上操作只能除去粗盐中难溶性杂质,欲除去可溶性杂质如MgCl2、CaCl2,得到纯净的NaCl,还需依次用到NaOH溶液、Na2CO3溶液和稀盐酸(三种药品均过量);
①碳酸钠溶液要过量的原因是 ;②稀盐酸的作用是 。
科学兴趣小组的同学做粗盐(只含有难溶性杂质)提纯实验,并用所得的精盐配制50g 6%的氯化钠溶液。回答下列问题:
实验一:粗盐提纯
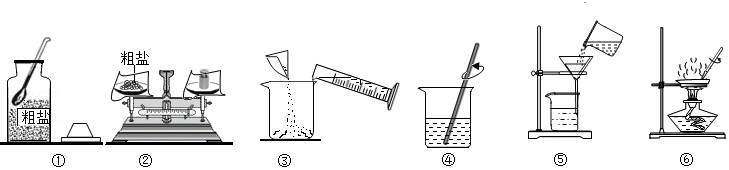
(1)如图中操作有错误的是 (填数字序号)。
(2)操作⑥中,当观察到蒸发皿中 时,停止加热。
(3)海水晒盐采用如图操作⑥的原理,不采用冷却氯化钠浓溶液的方法,原因是氯化钠的溶解度 。
实验二:用提纯得到的精盐配制50g 6%的氯化钠溶液
(1)计算。需要氯化钠 g,蒸馏水 mL。
(2)称量、量取。量取水的体积时,若仰视读数,所配溶液的溶质质量分数会 6%(填">""<"或"=")。
(3)溶解。用玻璃棒搅拌的目的是 。
(4)装瓶、贴标签。
“粗盐中难溶性杂质的去除”实验操作的主要步骤如图。
(1)操作A的名称为 。
(2)操作C中玻璃棒的作用是 。
(3)正确的操作顺序为 (填字母)。

通过海水晒盐可得到粗盐。化学兴趣小组为了除去粗盐中难溶性杂质,进行了如图操作:

(1)上述操作的正确顺序是 (填序号)。
(2)下列情况可能导致精盐产率偏低的是 (填字母代号)。
A.溶解时加入的水过少导致粗盐未溶完
B.过滤时漏斗内液面超过滤纸边缘
C.蒸发时有液体飞溅
D.所得精盐中含有少量水分
海洋是一个巨大的资源宝库。海水资源综合利用的部分途径如图。
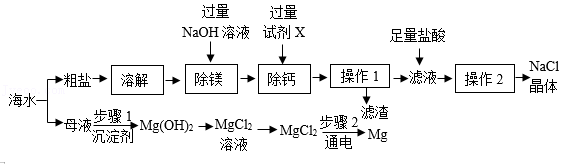
已知:粗盐中的杂质有泥沙、MgCl2、CaCl2,流程中部分操作及试剂已省略。
(1)试剂X的作用是除去粗盐中的Ca2+,则试剂X为 (填化学式)。
(2)“操作1”中玻璃棒的作用是 ,“操作2”的名称为 。
(3)滤渣中除泥沙外,还含有 。
(4)实际生产中,步骤1常选用 作为沉淀剂。
(5)步骤2需电解 状态的MgCl2以获得金属镁。
“久大盐化”是四川遂宁的重点企业,其生产的食盐是重要的调味品。绿色应用是化工生产的发展方向。为了除去NaCl溶液中含有的少量MgCl2、CaCl2和Na2SO4,某小组同学选用Na2CO3溶液、稀盐酸、Ba(OH)2溶液三种试剂,按一定顺序进行如图所示的实验。回答下列问题:

(1)操作a的名称是 。
(2)实验Ⅰ中加入的试剂B是 。(填序号)
①稀盐酸
②碳酸钠溶液
③氢氧化钡溶液
(3)实验Ⅱ中发生中和反应的化学方程式是 。
为除去粗盐中混有的泥沙,某学习小组按以下步骤进行实验:(实验环境温度为20℃)
Ⅰ.称量与溶解Ⅱ.过滤Ⅲ. 。
请回答下列问题:
(1)将步骤Ⅲ补充完整。
(2)如图中图1为氯化钠的溶解度曲线,图2为步骤Ⅰ中的部分操作:

①由图1给出的信息可知:20℃时,NaCl的溶解度是 g。
②从节约能源和提高产率的角度分析,图2中所需水的最佳体积是 mL.(提示:水的密度为1g•mL﹣1;产率 100%)
③用玻璃棒搅拌的目的是 。
(3)过滤时,若漏斗中的液面高于滤纸的边缘,造成的后果是 (填字母)。
a.过滤速度慢
b.滤纸破损
c.部分杂质未经过滤进入滤液
试题篮
()