如图是某实验小组做粗盐提纯实验的部分操作示意图。下列有关实验叙述错误的是( )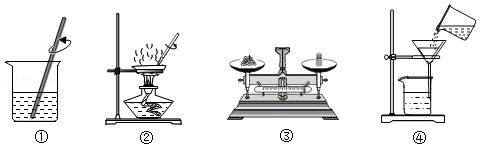
A.④中缺少玻璃棒引流溶液
B.①中玻璃棒的作用是搅拌,加速粗盐溶解
C.上述操作顺序为③①②④
D.当②蒸发皿中出现较多固体时,停止加热
学会物质的分离提纯和准确配制一定质量分数的溶液在实际应用中有重要意义。
(已知:20℃氯化钠的溶解度为36g,水的密度可近似看作1g/mL)
实验一:溶液配制
(1)用氯化钠固体配制100g质量分数为5%的氯化钠溶液。需要氯化钠 g,水 mL。
(2)0.9%的医用氯化钠溶液俗称生理盐水,可用于补充人体所需电解质。生理盐水中的溶质为 。
实验二:粗盐提纯

(3)操作①中玻璃棒的作用是 ,操作②的名称为 。
(4)20℃时提纯9g粗盐,若已知粗盐中氯化钠含量约为80%,溶解时应选择哪一种规格的量筒量取所需要的水最为合适(提供的量筒规格有“10mL“”、“25mL”和“100mL”),请你选择并说明理由 。
(5)提纯后的精盐属于 (填“纯净物”或“混合物”)。
实验技能是学习化学和进行探究活动的基础和保证。

(1)实验室配制50g质量分数为6%的NaCl溶液,用到的玻璃仪器除试剂瓶、量筒、胶头滴管外,还需要 。量取读数时,如图视线角度正确的是 (填序号)。
(2)请根据如图装置或操作回答相关问题。
①选取图2中的序号,表示粗盐提纯的正确操作顺序为 。操作B的名称是 ,该操作中当 时,应停止加热。
②实验室用高锰酸钾固体制取氧气时,可选用的发生装置是 (填序号)。
如图为“去除粗盐中难溶性杂质并计算产率”的实验操作示意图:

(1)请将上述操作进行合理排序: (填序号)、计算;请改正操作④中的错误 ;
(2)操作②中,用玻璃棒不断搅拌的目的是 ;
(3)过滤后,如果滤液仍然浑浊,其原因可能是 ;
(4)通过以上操作只能除去粗盐中难溶性杂质,欲除去可溶性杂质如MgCl2、CaCl2,得到纯净的NaCl,还需依次用到NaOH溶液、Na2CO3溶液和稀盐酸(三种药品均过量);
①碳酸钠溶液要过量的原因是 ;②稀盐酸的作用是 。
海水"晒盐"得到的是粗盐,粗盐提纯的步骤可简单的概括为:溶解﹣过滤﹣蒸发,下列说法错误的是( )
| A. |
实验前需要查阅资料,了解食盐在室温时的溶解度 |
| B. |
粗盐若未能充分溶解,则实验结果中食盐的含量将偏低 |
| C. |
过滤后得到的滤渣是粗盐中的难溶性杂质 |
| D. |
蒸发时需将滤液全部蒸干再停止加热 |
已知粗盐中含有泥沙、氯化钙和硫酸镁等杂质。为制得纯净的氯化钠固体,某化学兴趣小组进行了如下操作:
(1)写出X溶液中溶质的化学式 。
(2)请设计实验证明溶液B中含有NaOH.(简要写出实验步骤和现象)
(3)最后制得氯化钠的质量大于粗盐中氯化钠的质量,写出一个可使氯化钠质量增加的化学方程式 。
在“粗盐难溶性杂质的去除”实验中,操作步骤为:溶解、过滤、蒸发、计算产率。下列各步骤的一些做法正确的是( )
A.溶解:用玻璃棒搅拌以加速溶解
B.过滤:直接将粗盐水倒入漏斗中
C.蒸发:等蒸发皿中水分蒸干便停止加热
D.计算产率:将精盐直接转移到天平的托盘上称量
除去NaCl溶液中CaCl2、MgCl2、Na2SO4杂质的操作有:①溶解;②依次加过量的BaCl2、NaOH、Na2CO3溶液;③过滤;④加适量的盐酸;⑤蒸发结晶。
(1)过滤后滤液中的溶质有 种,过滤中玻璃棒的作用是 。
(2)加盐酸后反应的化学方程式为 。(写出一个即可)
请从A或B两题中任选一个作答,若两题均作答,按35﹣A计分.
| A用浓硫酸配制100g 9.8%的稀硫酸 |
B粗盐中难溶性杂质的去除 |
| (1)实验需要5.4mL浓硫酸和90mL水.量取两种液体用到的仪器有 (填序号). (2)稀释时,需将浓硫酸缓慢倒入水中,并不断进行搅拌,其原因是 . |
(1)过滤需要用到的仪器有 (填序号). (2)蒸发过程中,需不断进行搅拌,其原因是 . |
| 可供选择的主要仪器: ①试管 ②烧杯 ③蒸发皿 ④托盘天平 ⑤10mL量筒 ⑥100mL量筒 ⑦药匙 ⑧胶头滴管 ⑨漏斗 ⑩酒精灯⑪铁架台⑫玻璃棒 |
|
| |
|
在“一定质量分数的氯化钠溶液的配制”和“粗盐中难溶性杂质的去除”两个实验中都能使用到的仪器是( )
A.烧杯、玻璃棒、托盘天平、量筒
B.烧杯、玻璃棒、托盘天平、试管
C.托盘天平、量筒、烧杯、漏斗
D.蒸发皿、酒精灯、烧杯、铁架台
化学与人类的生产生活密切相关,已为人类的进步作出了巨大的贡献。请用所学的化学知识回答下列问题。
(1)生活中常接触到"加碘食盐","高钙牛奶",其中的"碘"和"钙"应理解为 (填编号)。
A元素 B.原子 C.单质
(2)糖类物质是人体能量的主要来源,其中最基本的糖类物质是葡萄糖,其化学式为 。当血液中的葡萄糖浓度过低时,人会产生头晕、心悸等低血糖症状,因此我们每天去合理摄入糖类物质。
(3)"84"消毒液是一种常用的消毒剂,其主要成分是次氯酸钠(NaClO),制取它的方程式为2NaOH+Cl 2=NaClO+X+H 2O,则X的化学式为
(4)不法分子,常用铜锌合金假冒黄金行骗,请你写出一种鉴别真假黄金的化学方法:
(5)某工厂用粗盐配制的氯化钠溶液中,经分析发现含有少量的氯化钙杂质,请你写出,除去该杂质的化学方程式: 。
有关“粗盐中难溶性杂质的去除”实验中说法不正确的是( )
A.多加水,让粗盐加速溶解
B.玻璃棒用了4次,但作用各不相同
C.粗盐经过溶解、过滤、蒸发、结晶可以得到初步提纯
D.当蒸发皿中出现较多量固体时,停止加热,利用余热使滤液蒸干
粗盐中含有泥沙等不溶性杂质,还含有氯化钙、氯化镁、硫酸钠等可溶性杂质。
提纯粗盐并制取纯碱的工艺流程如图:
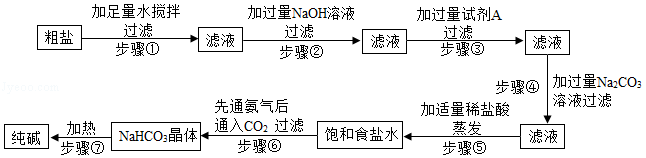
已知:①20℃时,将CO2通入含有NH3的饱和NaCl溶液中生成NaHCO3晶体和NH4Cl溶液
②20℃时,几种物质在水中的溶解度/g
NaCl |
NH4Cl |
NaHCO3 |
36.0 |
37.2 |
9.6 |
请根据上述题中有关信息,回答下列问题:
(1)步骤③中加入试剂A的化学式是 ;
(2)步骤④中加入过量Na2CO3溶液的目的是 ;
(3)在步骤⑥反应中,有NaHCO3晶体析出,而没有NH4Cl和NaCl析出的原因是 ;
(4)步骤⑦中NaHCO3转化为纯碱的化学反应方程式是2NaHCO3 Na2CO3+CO2↑+H2O,该化学反应属于 反应(填基本反应类型)。
请回答下列问题。
(1)下列实验操作的说法正确的是 (多选,请在答题卡选择题区域填涂作答)。
A.加热蒸发皿时,要垫上石棉网
B.电解水实验中,加入少量Na2SO4以增强水的导电性
C.氢气还原CuO实验中,先通入氢气,后加热
D.用pH试纸放入待测溶液中,测得pH=2
E.将NaOH固体直接置于托盘天平右盘上称量
(2)粗盐中含有少量CaCl2、MgSO4、Na2SO4,和泥沙等杂质。请完成提纯操作:①将固体粗盐样品 ②依次加入稍过量的 A NaOH溶液、B.Na2CO3溶液C BaCl2溶液,加入试剂的先后顺序用字母表示为 → → ;③过滤除去沉淀,再加稍过量的稀盐酸;④蒸发结晶。从NaCl的溶解度与温度的关系看,在结晶过程中,不采用冷却热的饱和溶液的方法获得晶体,理由是 。
试题篮
()