为了培养学生的创新精神和实践能力,落实素质教育,近年来,怀化市大力推进实验教学,于2021年五月举行初中毕业考试实验操作考查。兴趣小组在学校的实验室进行【粗盐的提纯】实验,邀请你一起完成。
Ⅰ.溶解
Ⅱ.过滤
过滤时玻璃棒的作用是 。
小李同学对过滤后滤液的成分产生了浓厚的兴趣。
【查阅资料】
a.粗盐中除含泥沙等难溶性杂质外还含有CaCl2、MgCl2、Na2SO4等可溶性杂质。
b.BaSO4不溶于水、不溶于酸。
【设计实验方案并进行实验】为确认滤液中CaCl2、MgCl2、Na2SO4的存在,小李利用实验台上的NaOH溶液、BaCl2溶液、Na2CO3溶液进行以下实验探究。
实验操作 |
实验现象 |
实验结论 |
①往上述所得的滤液中加入足量的NaOH溶液,充分反应,静置,过滤 |
|
滤液中含有MgCl2 |
②往上述①的滤液中滴加足量的 ,充分反应,静置,过滤 |
|
滤液中含有CaCl2 |
③往上述②的滤液中加入足量的 ,充分反应,静置,过滤 |
有白色沉淀生成 |
滤液中含有Na2SO4. |
【实验反思】小宇同学认为实验③不够严谨,理由是 。老师告诉同学们,可在实验③所得的沉淀中加入足量的 (填“盐酸”或“稀硫酸”),观察到有气泡产生且有部分沉淀未溶解,则可验证Na2SO4的存在。
【实验结论】小组同学在老师的帮助下将上述杂质除去,然后将除杂后的滤液置于蒸发皿进行蒸发结晶,当观察到 ,就停止加热,利用余热蒸干。小李高兴的宣布:我们得到了纯净的氯化钠。
【实验拓展】小李欲通过计算检验氯化钠样品中是否含有氯化镁,取样品ag,充分溶解,滴加硝酸银溶液至不再产生沉淀为止。当产生沉淀的质量不等于 g(用含a的代数式表示)时,则含有氯化镁。
某兴趣小组进行粗盐(杂质只含有泥沙)提纯实验,并利用所得精盐配制100g溶质质量分数为15%的氯化钠溶液。请完成下列问题:
实验一:如图是甲同学进行粗盐提纯实验的操作示意图。
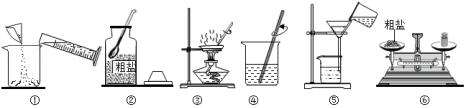
(1)进行操作③时,当观察到 时,停止加热。
(2)操作④中玻璃棒的作用是 。
(3)操作⑤中有一处明显的错误,请你帮他们指出来 。图中错误改正后,粗盐提纯实验的正确操作顺序为 (填操作示意图的序号)。
实验二:乙同学用提纯得到的精盐配制100g溶质质量分数为15%的氯化钠溶液(假设称量氯化钠时1g以下用游码)。
(4)配制时,除图中提供的仪器外,还需要试剂瓶、镊子和 (填一种仪器名称)。
(5)称量氯化钠时如果发现指针偏向右侧,正确的操作是 ,如果称量时氯化钠和砝码位置颠倒了,其它操作步骤均正确,则所配制溶液的溶质质量分数 (填“大于”“等于”或“小于”)15%。
(6)量水时应选择量筒的规格是 mL(填“10”“50”或“100”)。
【反思拓展】
(7)经检测所配溶液的溶质质量分数偏小,原因可能是 (列举一条即可)。
(8)海水晒盐采用操作③的原理而不用冷却氯化钠热饱和溶液的方法,原因是 。
下列有关粗盐提纯实验中的相关装置和操作,正确的是( )
| A. |
|
B. |
|
| C. |
|
D. |
|
下列对实验结果分析正确的是( )
| A. |
测定空气里氧气含量时,若装置漏气,会导致测定结果偏高 |
| B. |
除去粗盐中难溶性杂质的过程中,若蒸发时液体溅出,会导致产率偏低 |
| C. |
验证质量守恒定律时,若不采用密闭装置,一定会导致反应前后质量总和不相等 |
| D. |
配制一定溶质质量分数的溶液,若装瓶时洒出一部分,会导致溶质质量分数变小 |
科学兴趣小组的同学做粗盐(只含有难溶性杂质)提纯实验,并用所得的精盐配制50g 6%的氯化钠溶液。回答下列问题:
实验一:粗盐提纯
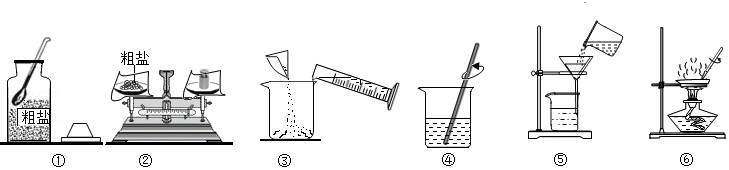
(1)如图中操作有错误的是 (填数字序号)。
(2)操作⑥中,当观察到蒸发皿中 时,停止加热。
(3)海水晒盐采用如图操作⑥的原理,不采用冷却氯化钠浓溶液的方法,原因是氯化钠的溶解度 。
实验二:用提纯得到的精盐配制50g 6%的氯化钠溶液
(1)计算。需要氯化钠 g,蒸馏水 mL。
(2)称量、量取。量取水的体积时,若仰视读数,所配溶液的溶质质量分数会 6%(填">""<"或"=")。
(3)溶解。用玻璃棒搅拌的目的是 。
(4)装瓶、贴标签。
如图为“去除粗盐中难溶性杂质并计算产率”的实验操作示意图:

(1)请将上述操作进行合理排序: (填序号)、计算;请改正操作④中的错误 ;
(2)操作②中,用玻璃棒不断搅拌的目的是 ;
(3)过滤后,如果滤液仍然浑浊,其原因可能是 ;
(4)通过以上操作只能除去粗盐中难溶性杂质,欲除去可溶性杂质如MgCl2、CaCl2,得到纯净的NaCl,还需依次用到NaOH溶液、Na2CO3溶液和稀盐酸(三种药品均过量);
①碳酸钠溶液要过量的原因是 ;②稀盐酸的作用是 。
通过海水晒盐可得到粗盐。化学兴趣小组为了除去粗盐中难溶性杂质,进行了如图操作:

(1)上述操作的正确顺序是 (填序号)。
(2)下列情况可能导致精盐产率偏低的是 (填字母代号)。
A.溶解时加入的水过少导致粗盐未溶完
B.过滤时漏斗内液面超过滤纸边缘
C.蒸发时有液体飞溅
D.所得精盐中含有少量水分
“粗盐中难溶性杂质的去除”实验操作的主要步骤如图。
(1)操作A的名称为 。
(2)操作C中玻璃棒的作用是 。
(3)正确的操作顺序为 (填字母)。

海洋是一个巨大的资源宝库。海水资源综合利用的部分途径如图。
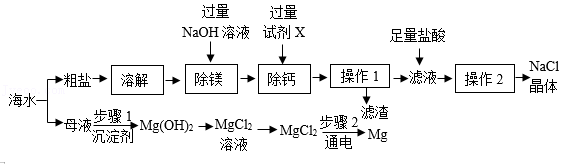
已知:粗盐中的杂质有泥沙、MgCl2、CaCl2,流程中部分操作及试剂已省略。
(1)试剂X的作用是除去粗盐中的Ca2+,则试剂X为 (填化学式)。
(2)“操作1”中玻璃棒的作用是 ,“操作2”的名称为 。
(3)滤渣中除泥沙外,还含有 。
(4)实际生产中,步骤1常选用 作为沉淀剂。
(5)步骤2需电解 状态的MgCl2以获得金属镁。
“久大盐化”是四川遂宁的重点企业,其生产的食盐是重要的调味品。绿色应用是化工生产的发展方向。为了除去NaCl溶液中含有的少量MgCl2、CaCl2和Na2SO4,某小组同学选用Na2CO3溶液、稀盐酸、Ba(OH)2溶液三种试剂,按一定顺序进行如图所示的实验。回答下列问题:

(1)操作a的名称是 。
(2)实验Ⅰ中加入的试剂B是 。(填序号)
①稀盐酸
②碳酸钠溶液
③氢氧化钡溶液
(3)实验Ⅱ中发生中和反应的化学方程式是 。
为除去粗盐中混有的泥沙,某学习小组按以下步骤进行实验:(实验环境温度为20℃)
Ⅰ.称量与溶解Ⅱ.过滤Ⅲ. 。
请回答下列问题:
(1)将步骤Ⅲ补充完整。
(2)如图中图1为氯化钠的溶解度曲线,图2为步骤Ⅰ中的部分操作:

①由图1给出的信息可知:20℃时,NaCl的溶解度是 g。
②从节约能源和提高产率的角度分析,图2中所需水的最佳体积是 mL.(提示:水的密度为1g•mL﹣1;产率 100%)
③用玻璃棒搅拌的目的是 。
(3)过滤时,若漏斗中的液面高于滤纸的边缘,造成的后果是 (填字母)。
a.过滤速度慢
b.滤纸破损
c.部分杂质未经过滤进入滤液
去除难溶性杂质后的食盐样品中还含有可溶性杂质:CaCl2、MgCl2和Na2SO4.为除去可溶性杂质,将食盐样品溶于水,依次加入稍过量的三种溶液:BaCl2溶液、NaOH溶液、Na2CO3溶液。充分反应后过滤,得滤渣X,向滤液中加入过量的稀盐酸,搅拌、煮沸,得氯化钠溶液。下列说法正确的是( )

A.滤渣X中有三种成分
B.“向滤液中加入过量的稀盐酸”目的只是为了除去过量的NaOH
C.除杂过程中有Na2CO3参加的化学反应为复分解反应
D.将氯化钠溶液用题图装置加热蒸发,至水分完全蒸干时停止加热
如图是某实验小组做粗盐提纯实验的部分操作示意图。下列有关实验叙述错误的是( )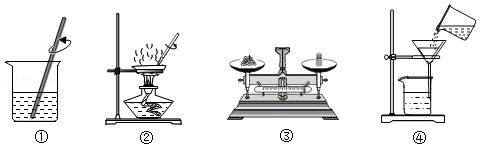
A.④中缺少玻璃棒引流溶液
B.①中玻璃棒的作用是搅拌,加速粗盐溶解
C.上述操作顺序为③①②④
D.当②蒸发皿中出现较多固体时,停止加热
某化学兴趣小组做粗盐提纯实验,并对粗盐的成分作进一步探究。请回答下列问题:
实验一:粗盐提纯
(1)提纯实验多次用到了玻璃棒,请写出该实验中使用玻璃棒的一个作用① ;
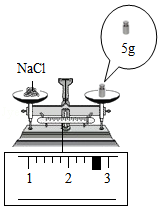
(2)蒸发后所得食盐质量② (读数见图)。
实验二:物质检验
[提出问题]食盐中除含有NaCl外,可能还含有什么溶质?
查阅资料一]食盐中可能还含有Na2CO3、Na2SO4等。
[作出猜想]猜想一:含有溶质Na2CO3;
猜想二:含有溶质Na2SO4;
猜想三:③ 。
[查阅资料二]Na2CO3溶液、Na2SO4溶液均可以与BaCl2溶液反应生成白色沉淀,且BaCO3可以溶于盐酸,BaSO4不能溶于盐酸。
[讨论交流]小组同学经讨论后认为:选择BaCl2溶液和稀盐酸两种试剂即可验证猜想。若猜想二正确,则发生反应的化学方程式为④ 。
[实验验证]为验证猜想,小组同学设计了如下实验方案。
Ⅰ.取上述食盐样品少量于试管中,加水溶解,得到澄清透明溶液;
Ⅱ.向溶液中滴加过量的BaCl2溶液,生成白色沉淀,静置;
Ⅲ.静置后弃去清液,加入足量稀盐酸,发现沉淀部分溶解,且有气泡产生。
[实验结论]根据上述实验现象判断⑤ 是正确的(填“猜想一”、“猜想二”或“猜想三”)。
[问题与交流]小组同学在实验报告中记录了如下文字:经实验验证,该食盐样品中仅含有NaCl、Na2CO3和Na2SO4,你认为这个观点⑥ (填“正确”或“错误”)。请说明你选择的理由⑦ 。
粗盐中含有泥沙等不溶性杂质,还含有氯化钙、氯化镁、硫酸钠等可溶性杂质。
提纯粗盐并制取纯碱的工艺流程如图:
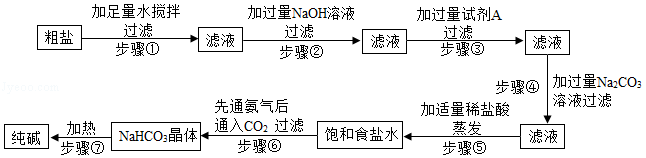
已知:①20℃时,将CO2通入含有NH3的饱和NaCl溶液中生成NaHCO3晶体和NH4Cl溶液
②20℃时,几种物质在水中的溶解度/g
NaCl |
NH4Cl |
NaHCO3 |
36.0 |
37.2 |
9.6 |
请根据上述题中有关信息,回答下列问题:
(1)步骤③中加入试剂A的化学式是 ;
(2)步骤④中加入过量Na2CO3溶液的目的是 ;
(3)在步骤⑥反应中,有NaHCO3晶体析出,而没有NH4Cl和NaCl析出的原因是 ;
(4)步骤⑦中NaHCO3转化为纯碱的化学反应方程式是2NaHCO3 Na2CO3+CO2↑+H2O,该化学反应属于 反应(填基本反应类型)。
试题篮
()