在"粗盐中难溶性杂质的去除"实验中,操作步骤为溶解、过滤、蒸发、计算产率。这四步操作中均要用到的一种仪器是( )
| A. |
烧杯 |
B. |
漏斗 |
C. |
玻璃棒 |
D. |
酒精灯 |
如图是某实验小组做粗盐提纯实验的部分操作示意图。下列有关实验叙述错误的是( )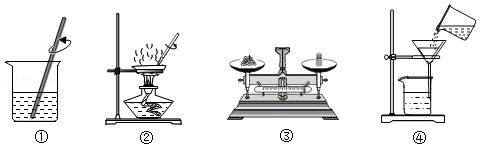
A.④中缺少玻璃棒引流溶液
B.①中玻璃棒的作用是搅拌,加速粗盐溶解
C.上述操作顺序为③①②④
D.当②蒸发皿中出现较多固体时,停止加热
学会物质的分离提纯和准确配制一定质量分数的溶液在实际应用中有重要意义。
(已知:20℃氯化钠的溶解度为36g,水的密度可近似看作1g/mL)
实验一:溶液配制
(1)用氯化钠固体配制100g质量分数为5%的氯化钠溶液。需要氯化钠 g,水 mL。
(2)0.9%的医用氯化钠溶液俗称生理盐水,可用于补充人体所需电解质。生理盐水中的溶质为 。
实验二:粗盐提纯

(3)操作①中玻璃棒的作用是 ,操作②的名称为 。
(4)20℃时提纯9g粗盐,若已知粗盐中氯化钠含量约为80%,溶解时应选择哪一种规格的量筒量取所需要的水最为合适(提供的量筒规格有“10mL“”、“25mL”和“100mL”),请你选择并说明理由 。
(5)提纯后的精盐属于 (填“纯净物”或“混合物”)。
实验技能是学习化学和进行探究活动的基础和保证。

(1)实验室配制50g质量分数为6%的NaCl溶液,用到的玻璃仪器除试剂瓶、量筒、胶头滴管外,还需要 。量取读数时,如图视线角度正确的是 (填序号)。
(2)请根据如图装置或操作回答相关问题。
①选取图2中的序号,表示粗盐提纯的正确操作顺序为 。操作B的名称是 ,该操作中当 时,应停止加热。
②实验室用高锰酸钾固体制取氧气时,可选用的发生装置是 (填序号)。
在“一定质量分数的氯化钠溶液的配制”和“粗盐中难溶性杂质的去除”两个实验中都能使用到的仪器是( )
A.烧杯、玻璃棒、托盘天平、量筒
B.烧杯、玻璃棒、托盘天平、试管
C.托盘天平、量筒、烧杯、漏斗
D.蒸发皿、酒精灯、烧杯、铁架台
已知粗盐中含有泥沙、氯化钙和硫酸镁等杂质。为制得纯净的氯化钠固体,某化学兴趣小组进行了如下操作:
(1)写出X溶液中溶质的化学式 。
(2)请设计实验证明溶液B中含有NaOH.(简要写出实验步骤和现象)
(3)最后制得氯化钠的质量大于粗盐中氯化钠的质量,写出一个可使氯化钠质量增加的化学方程式 。
在“粗盐难溶性杂质的去除”实验中,操作步骤为:溶解、过滤、蒸发、计算产率。下列各步骤的一些做法正确的是( )
A.溶解:用玻璃棒搅拌以加速溶解
B.过滤:直接将粗盐水倒入漏斗中
C.蒸发:等蒸发皿中水分蒸干便停止加热
D.计算产率:将精盐直接转移到天平的托盘上称量
除去NaCl溶液中CaCl2、MgCl2、Na2SO4杂质的操作有:①溶解;②依次加过量的BaCl2、NaOH、Na2CO3溶液;③过滤;④加适量的盐酸;⑤蒸发结晶。
(1)过滤后滤液中的溶质有 种,过滤中玻璃棒的作用是 。
(2)加盐酸后反应的化学方程式为 。(写出一个即可)
完成下列实验。
(1)现提供下列装置:

①写出上图中B装置甲仪器的名称 。
②实验室用A装置进行高锰酸钾制氧气的实验,化学方程式为 ,用D装置收集氧气,气体由导管 进入(填“a”或“b”)
③实验室用锌粒和稀盐酸制氢气,用C装置代替B装置的优点是 :若要检验氧气中是否含有氯化氢气体,可将气体通过盛有 溶液的D装置(填“AgNO3”或“饱和NaHCO3溶液”)
(2)对一定质量的粗盐(含泥沙)进行初步提纯。
①实验主要步骤:称量与 、过滤、蒸发;实验中多次使用玻璃棒。过滤时它的作用是 ;蒸发时,待蒸发皿中出现 时停止加热。利用余热将滤液蒸干。
②下列因素会导致获得的精盐质量偏小的是 (填序号)
a.蒸发时液滴溅出 b.过滤时,滤纸破损
c.粗盐中加入过量的水 d.过滤后,滤纸上的泥沙未同水冲洗。
下列实验方法错误的是( )
选项 |
实验目的 |
实验方法 |
A |
鉴别硬水和软水 |
加入肥皂水振荡,观察是否有大量泡沫 |
B |
鉴别蔗糖和NH4NO3固体 |
加入少量水溶解,测量溶液温度 |
C |
除去粗盐在难溶性杂质 |
加适量水溶解,过滤,蒸发 |
D |
除去KCl溶液中少量CuCl2 |
滴加NaOH溶液至不再生成沉淀,过滤 |
A.AB.BC.CD.D
通过海水晒盐可得到粗盐。化学兴趣小组为了除去粗盐中难溶性杂质,进行了如图操作:

(1)上述操作的正确顺序是 (填序号)。
(2)下列情况可能导致精盐产率偏低的是 (填字母代号)。
A.溶解时加入的水过少导致粗盐未溶完
B.过滤时漏斗内液面超过滤纸边缘
C.蒸发时有液体飞溅
D.所得精盐中含有少量水分
海水"晒盐"得到的是粗盐,粗盐提纯的步骤可简单的概括为:溶解﹣过滤﹣蒸发,下列说法错误的是( )
| A. |
实验前需要查阅资料,了解食盐在室温时的溶解度 |
| B. |
粗盐若未能充分溶解,则实验结果中食盐的含量将偏低 |
| C. |
过滤后得到的滤渣是粗盐中的难溶性杂质 |
| D. |
蒸发时需将滤液全部蒸干再停止加热 |
粗盐中含有泥沙等不溶性杂质,还含有氯化钙、氯化镁、硫酸钠等可溶性杂质。
提纯粗盐并制取纯碱的工艺流程如图:
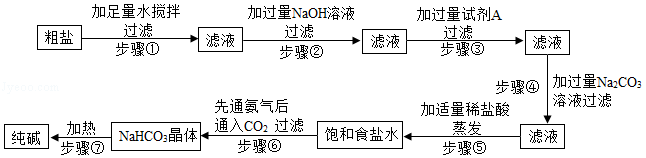
已知:①20℃时,将CO2通入含有NH3的饱和NaCl溶液中生成NaHCO3晶体和NH4Cl溶液
②20℃时,几种物质在水中的溶解度/g
NaCl |
NH4Cl |
NaHCO3 |
36.0 |
37.2 |
9.6 |
请根据上述题中有关信息,回答下列问题:
(1)步骤③中加入试剂A的化学式是 ;
(2)步骤④中加入过量Na2CO3溶液的目的是 ;
(3)在步骤⑥反应中,有NaHCO3晶体析出,而没有NH4Cl和NaCl析出的原因是 ;
(4)步骤⑦中NaHCO3转化为纯碱的化学反应方程式是2NaHCO3 Na2CO3+CO2↑+H2O,该化学反应属于 反应(填基本反应类型)。
请回答下列问题。
(1)下列实验操作的说法正确的是 (多选,请在答题卡选择题区域填涂作答)。
A.加热蒸发皿时,要垫上石棉网
B.电解水实验中,加入少量Na2SO4以增强水的导电性
C.氢气还原CuO实验中,先通入氢气,后加热
D.用pH试纸放入待测溶液中,测得pH=2
E.将NaOH固体直接置于托盘天平右盘上称量
(2)粗盐中含有少量CaCl2、MgSO4、Na2SO4,和泥沙等杂质。请完成提纯操作:①将固体粗盐样品 ②依次加入稍过量的 A NaOH溶液、B.Na2CO3溶液C BaCl2溶液,加入试剂的先后顺序用字母表示为 → → ;③过滤除去沉淀,再加稍过量的稀盐酸;④蒸发结晶。从NaCl的溶解度与温度的关系看,在结晶过程中,不采用冷却热的饱和溶液的方法获得晶体,理由是 。
试题篮
()