氮化硼(BN)陶瓷基复合材料在航天领域应用广泛。硼单质是制备氮化硼(BN)的原料之一,某工厂利用硼砂(主要成分为Na2B4O7•10H2O,杂质中含少量Fe3+)制备硼(B)单质的部分流程如图所示:
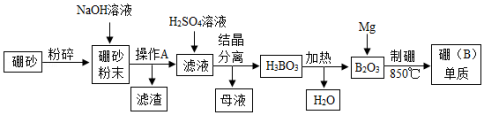
请完成下列问题:
(1)粉碎硼砂的目的是 。
(2)操作A的名称是 。
(3)滤渣的成分为 (填化学式)。
(4)写出H3BO3加热分解的化学方程式 。
(5)“制硼”反应的化学方程式为 。
某工厂废液中含有氯化钠、氯化铜和氯化亚铁。某课外小组要从废液中回收铜并得到铁红(主要成分Fe2O3),要求全过程不引入其他金属元素。设计实验方案如图所示:
请回答下列问题:
(1)工厂废液中加入过量A反应的化学方程式为 。
(2)用化学式表示固体甲的成分 。
(3)溶液甲中的金属离子是 (用离子符号表示)。
(4)完成步骤④的化学方程式:4Fe(OH)2+O2+2 ═4Fe(OH)3。
海水是一种重要资源,利用海水可制取镁等物质,某化学兴趣小组的同学设计了如下实验流程进行实验:
分析该流程图,下列说法错误的是( )
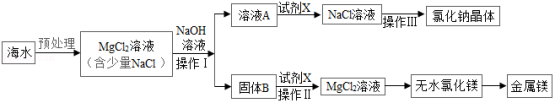
A.操作Ⅰ,操作Ⅲ都需用到的玻璃仪器是玻璃棒
B.固体B是Mg(OH. 2,试剂X是盐酸
C.加入NaOH溶液应过量,其目的是使MgCl 2完全反应
D.处理等量海水,若将NaOH溶液换成石灰乳,既能节约成本又能提高镁的产量
如果将物质按单质、氧化物、酸、碱、盐、有机物分类,如图中甲、乙、丙、丁是四种不同类别的物质,且相连物质之间均能发生化学反应。下列说法符合图示要求的是( )
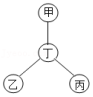
| A. |
当甲、乙、丙分别为酸、碱、盐时,丁可以为碳酸钠 |
| B. |
当甲为氯化铜时,丁可以为氢氧化钠 |
| C. |
当丁为氧气时,甲、乙、丙可以为红磷、甲烷、一氧化碳 |
| D. |
当丁为盐酸时,甲、乙、丙可以为铜、硝酸银、氢氧化钙 |
氢基熔融冶金技术是利用氢作为还原剂代替碳还原剂,从而实现减少CO2排放的目的,实现低碳冶金。氢基熔融还原生产高纯铸造生铁的主要流程如图所示(部分略去)。
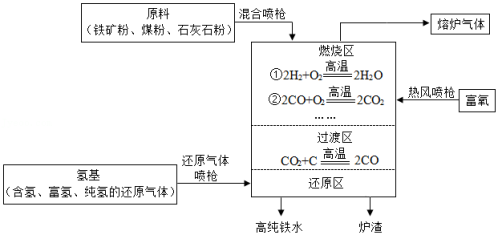
(1)燃烧区的作用是 ,燃烧区发生燃烧反应的物质还有 (填化学式)。
(2)还原区的反应除3CO+Fe2O3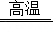 2Fe+3CO2,另一主要反应的化学方程式是 。
2Fe+3CO2,另一主要反应的化学方程式是 。
(3)从环境保护角度,与高炉炼铁技术相比,氢基熔融冶金技术的优点是 。
铝在地壳中主要以铝土矿的形式存在,铝土矿的主要成分为Al2O3(含有少量Fe2O3、SiO2等杂质)。工业上冶炼铝的工艺流程见如图:
(1)铝土矿中的SiO2不溶于水,也不与盐酸反应,操作①的目的是 ;
(2)操作③得到的Al(OH)3受热分解生成Al2O3,该反应的化学方程式为 ,铝土矿经过操作①~④的目的是 ;
(3)在冰晶石作助熔剂条件下,高温电解Al2O3得到金属铝,该反应的化学方程式为 。
下列物质间的转化关系,不能实现的是( )
A.C→CO2→COB.Mg→MgO→MgSO4
C.KCl→KNO3→K2SO4D.NaOH→Na2CO3→NaCl
海洋是人类宝贵的自然资源,海水“晒盐”和海水“制碱”体现了人类利用和改造自然的智慧,请根据粗盐“制碱”的流程图(如图)回答问题:
(1)步骤Ⅰ除杂中,常见的方法有两种:一是物理方法,即用NaCl溶液浸洗粗盐,溶解除去其中的可溶性杂质,则浸洗溶液应选用NaCl的 (填“饱和”或“不饱和”)溶液;二是化学方法,操作步骤依次为:加水溶解→加过量试剂①→加过量试剂②→过滤→加适量盐酸,以下试剂①②组合选用合理的是 。
A.①Ca(OH)2②Na2CO3
B.①Na2CO3②Ca(OH)2
C.①KOH②Na2CO3
D.①NaOH②Na2CO3
(2)步骤Ⅲ先向饱和食盐水中通入氨气,再通入二氧化碳,这样做的目的是 ,写出步骤Ⅲ反应的化学方程式 。
(3)步骤Ⅳ发生的反应属于 反应(填基本反应类型)。
(4)我国化学家侯德榜创立的联合制碱法的优点有 。
A.无“索尔维氨碱法”中的废弃物CaCl2生成,有利于保护环境
B.大大提高了食盐的利用率,节约了成本
C.将“制碱”与制氨生产联合起来,同时析出的NH4Cl晶体可用作复合肥
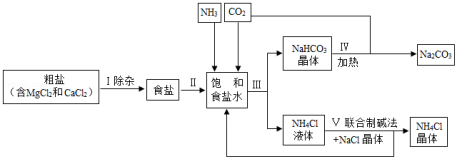
硝酸溶解废旧CPU所得溶液中含有Cu2+和Ag+,用适当浓度的盐酸、氯化钠溶液、氨水和铁粉,按照如图方法回收Cu和Ag(图中标注的试剂均不同)。
(1)加入过量Fe粉发生的主要反应为 (写化学方程式)。
(2)试剂1和试剂3的名称依次是 。
(3)若向66g物质1中加入100g试剂2后,恰好完全反应,剩余固体质量为60.4g。求所得溶液中溶质的质量分数(写出计算过程,计算结果精确到0.1%)。
人类常利用化学反应得到所需要的物质。如图是X、Y、Z、W四种物质的转化关系(都能通过一步反应实现),则X、Y、Z、W依次可能是( )

A.C、CO、CO2、H2CO3
B.H2O2、O2、H2O、H2
C.CaO、Ca(OH)2、CaCl2、CaCO3
D.Cu、CuO、Cu(OH)2、CuSO4
工业上可以通过如图工艺流程处理工厂排放的含二氧化硫的尾气,并获得硫酸和氢气。

主反应器中发生反应的化学方程式为:SO2+2H2O+I2═H2SO4+2HI
请回答下列问题:
(1)该反应的物质中属于氧化物的有 。
(2)该反应前后,化合价发生变化的元素有碘和 。
(3)尾气中SO2的质量分数为10%,若吸收该尾气80t,理论上能够生产硫酸的质量为
t。
(4)在整个工艺流程中,能被循环利用的物质是 。
江西赣州被誉为“世界钨都”,钨(W)是一种重要的战略资源。如图是一种生产钨的工业流程:
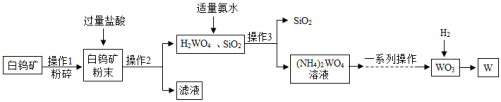
已知:白钨矿的主要成分是钨酸钙(CaWO4),还含有CaO、SiO2等;碳在高温条件下会与金属钨反应生成碳化钨。
(1)操作1中粉碎白钨矿的目的是 。
(2)操作2所得滤液中一定含有的阳离子是 、 。
(3)流程中氨水(NH3•H2O)和H2WO4反应生成(NH4)2WO4的化学方程式为 。
(4)用氢气还原WO3可获得高纯度的钨,此处不宜用焦炭代替氢气的原因是 。
(1)操作1中粉碎白钨矿的目的是增大反应物接触面积,加快反应速率;
(2)白钨矿的主要成分是钨酸钙(CaWO4),还含有CaO、SiO2,加入盐酸后二氧化硅没有参加反应,所以操作2所得滤液中一定含有的阳离子是Ca2+和过量的盐酸中的H+;
(3)反应物是NH3·H2O和H2WO4生成物是(NH4)2WO4,所以方程式是:2NH3·H2O+H2WO4═(NH4)2WO4+2H2O
(4)碳在高温条件下会与金属钨反应生成碳化钨,所以此处不宜用焦炭代替氢气。
以某菱镁矿石(主要成分是MgCO3,含少量MnCO3、SiO2)制取MgSO4•7H2O,流程如图:

(1)“酸浸”时,为了提高浸取率,除了搅拌、提高硫酸浓度外,还可采取的措施有
(写出一种)。此时,MnCO3发生反应的化学方程式是 。
(2)“转化”时主要反应是NaClO+MnSO4+H2O═MnO2↓+NaCl+H2SO4,氯元素反应前后化合价变化情况是 (填“升高”或“降低”)。
(3)硫酸镁溶液在不同温度下进行浓缩结晶,可得到不同的晶体:
温度/℃ |
﹣3.9~1.8 |
1.8~48.1 |
48.1~67.5 |
67.5~200 |
析出晶体 |
MgSO4•12H2O |
MgSO4•7H2O |
MgSO4•6H2O |
MgSO4•H2O等 |
①“操作1”的具体操作是:蒸发浓缩滤液至表面有晶膜出现(此时MgSO4溶液已饱和)、 、过滤、洗涤、低温干燥。
②“操作1”所得滤液中能分离出一种可循环使用的物质,该物质是 H2SO4 (填化学式)。循环使用的目的是 。
(4)已知:MgSO4•7H2O中镁元素质量分数为9.76%。采用热分析法测定所得MgSO4•7H2O样品中镁元素质量分数:
①未加热前,测得样品中镁元素质量分数略大于9.76%,可能的原因是 。
②高于900℃后,测得剩余固体中镁元素质量分数大于20%,可能的原因是 。
(5)若用100t菱镁矿石可制得246t MgSO4•7H2O产品,忽略反应过程中镁元素损失,求该菱镁矿石中MgCO3的质量分数。(写出计算过程)
已知:向饱和食盐水中通入氨气得到饱和铵盐水,饱和铵盐水能与CO2发生反应:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl。某学习小组以饱和食盐水等为原料制备纯碱的主要流程如图:
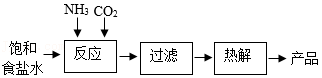
(1)常温时,饱和铵盐水的pH (填“=”或“>”)7。反应时,溶液中生成的NH4Cl中含有原子团的名称是 。
(2)过滤时,若经两次过滤滤液仍浑浊其原因可能是 (任写一条)。
(3)热解时,NaHCO3分解得到Na2CO3、CO2和H2O,该反应的化学方程式为 。
试题篮
()