金刚石、石墨、C 60都是由碳元素形成的单质,它们的原子排列方式不同,导致它们在性质上存在着明显差异。
(1)请写出另一组由同种元素形成的不同单质 。
(2)石墨具有优良的 ,常用作干电池的电极。
(3)硅是一种良好的半导体材料。工业上制粗硅的反应为:2C+SiO 2  Si+2CO↑,该反应中SiO 2发生 (填"氧化"或"还原")反应。
Si+2CO↑,该反应中SiO 2发生 (填"氧化"或"还原")反应。
(4)已知反应:2Mg+CO 2  2 +C,则Mg着火时 (填"能"或"不能")使用干粉灭火器灭火。
2 +C,则Mg着火时 (填"能"或"不能")使用干粉灭火器灭火。
氯化钠是生产、生活中的一种重要化合物,应用很广泛。
Ⅰ.图甲和图乙分别是钠原子和氯原子的原子结构示意图。

(1)图甲中的x= 。
(2)金属钠与氯气反应时,由图乙的结构可知,氯原子容易得到钠失去的1个电子,从而形成最外层有 个电子的相对稳定的氯离子,氯离子用化学符号表示为 。
Ⅱ.如表是氯化钠在不同温度下的溶解度数据。
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
37.8 |
(1)30℃时,将10g氯化钠加入到50g水中,充分搅拌后,所得到的氯化钠溶液属于
(填“饱和”或“不饱和”)溶液。
(2)医用盐水(溶质为NaCl)的溶质质量分数为0.9%,现有200mL该盐水(假定该溶液的密度为1g/mL),其中含NaCl的质量为 g。
(3)学生化学实验活动之一:配制50g质量分数为6%的氯化钠溶液,该实验需要的仪器有药匙、托盘天平、玻璃棒、胶头滴管、 (从下列图中选择写出名称)。

Ⅲ.工业上常用电解饱和食盐水的方法来制取氢氧化钠、氯气和氢气,其化学反应方程式可表示为:xNaCl+yH2O zNaOH+wH2+vCl2↑,若w=v=1,那么x=y=z=
zNaOH+wH2+vCl2↑,若w=v=1,那么x=y=z=
(填数字)。
根据实验图示回答下列问题:
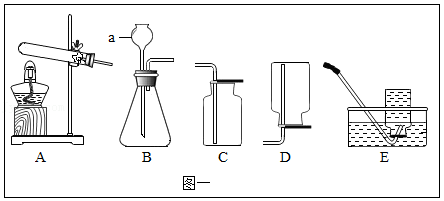
(1)写出图一中仪器a的名称 。
(2)实验室用加热高锰酸钾固体的方法制取氧气,选择的发生装置是 (填字母序字号),加热时,应使用酒精灯的 焰集中加热;检验氧气可用 。
(3)实验室制取CO2应选择的发生和收集装置是 (填字母序号),其反应的化学方程式为 。
(4)镁粉在火星上可以扮演地球上煤的角色,通过采用Mg/CO2金属粉末燃烧器可以为采矿车、电站等提供热能,其转化过程如图二:
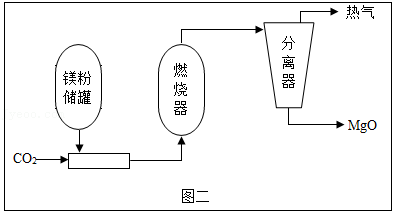
已知:燃烧器中发生的主要反应为Mg+CO2 MgO+CO。
MgO+CO。
①热气中一定含有的物质有 (写一种即可)。
②通过上述反应,你对燃烧条件的新认识是 。
将下列四种物质放入密闭容器中充分反应,测得反应前后各物质的质量如表。下列说法正确的是( )
| 物质 |
甲 |
乙 |
丙 |
丁 |
| 反应前质量/g |
1 |
10 |
27 |
4 |
| 反应后质量/g |
1 |
a |
0 |
23 |
| A. |
a的值是8 |
| B. |
甲物质一定是该反应的催化剂 |
| C. |
该反应属于分解反应 |
| D. |
反应过程中乙、丁的质量比是5:2 |
石笋和钟乳石的形成蕴含许多化学原理,其反应之一为:CO 2+H 2O+X═Ca(HCO 3) 2,则X的化学式为( )
A.CaCO 3 B.Ca(OH) 2 C.CaO D.CaH 2
已知某纯净物2.3g在足量的氧气中充分燃烧后,生成4.4g二氧化碳和2.7g水。下列关于该纯净物组成的说法正确的是( )
| A. |
只含有碳、氢元素 |
| B. |
一定含有碳、氢、氧三种元素 |
| C. |
一定含有碳、氢元素,可能含有氧元素 |
| D. |
一定含有碳元素,可能含有氢、氧元素 |
潜水员戴的呼吸面具中装有过氧化钠(Na 2O 2),它能吸收人体呼出的二氧化碳,其反应原理是2Na 2O 2+2CO 2═2Na 2CO 3+X。则X的化学式是( )
| A. |
CO |
B. |
H 2O |
C. |
SO 2 |
D. |
O 2 |
一定条件下,在密闭容器内发生某一化学反应,测得反应前后各物质的质量如表所示。
| 物质 |
甲 |
乙 |
丙 |
丁 |
| 反应前的质量/g |
3.2 |
16.8 |
0.8 |
0.1 |
| 反应后的质量/g |
x |
8.4 |
3.0 |
1.0 |
下列说法不正确的是( )
| A. |
x=8.5 |
| B. |
反应中生成丙与丁的质量比为3:1 |
| C. |
乙一定是化合物 |
| D. |
丙和丁的相对分子质量之比可能为22:9 |
头孢类消炎药是日常生活中常用的一类抗菌药物,注射或口服头孢类药物后一段时间内不能饮酒,否则会出现心率加快、血压下降,严重者会出现心力衰竭导致死亡,下列关于头孢氨苄(化学式:C 16H 17N 3O 4S)的说法不正确的是( )
A.属于有机化合物
B.由C、H、N、O、S五种元素组成
C.氢元素的质量分数最小
D.完全燃烧时只生成二氧化碳和水
大量实验证明,化学反应符合质量守恒定律。
(1)如图是铁钉与硫酸铜溶液反应的实验。
①反应一段时间,观察到的现象是 ;
②该反应的化学方程式是 ;
③溶液中减少的铜元素质量等于反应生成的 的质量。
(2)取足量的铁、锌,各加入相同质量相同溶质质量分数的稀盐酸,完全反应后,铁、锌均有剩余,下列说法正确的是 。
| A. |
生成氢气的质量相等 |
| B. |
生成的氯化亚铁和氯化锌的质量相等 |
| C. |
参加反应的铁和锌的质量相等 |
| D. |
参加反应的稀盐酸中HCl的质量相等 |
(3)经计算3g镁和100g质量分数7.3%的盐酸充分反应可生成氢气0.2g,但经实验测定,生成氢气的质量大于0.2g,则可能的原因是过量的镁与 发生反应。

分析和推理是化学学习中常用的思维方法。下列推理正确的是( )
| A. |
由不同种分子构成的物质是混合物,所以混合物一定是由不同种分子构成的 |
| B. |
某物质在氧气中燃烧生成水和二氧化碳,该物质一定含有碳、氢两种元素 |
| C. |
燃烧需要同时满足三个条件,所以只有同时破坏燃烧的三个条件才能灭火 |
| D. |
置换反应有单质和化合物生成,所以有单质和化合物生成的反应一定是置换反应 |
化学学习常用化学思维去认识和理解世界,下列说法错误的个数有( )
| 物质 |
甲 |
乙 |
丙 |
丁 |
| 反应前质量/g |
10 |
5 |
12 |
20 |
| 反应后质量/g |
8 |
5 |
30 |
x |
(1)反应中甲和丙的质量比为1:8
(2)x=4
(3)该反应为化合反应
(4)乙可能是催化剂
(5)若甲与丁的化学计量数之比为2:3;则其相对分子质量之比为3:16
| A. |
1个 |
B. |
2个 |
C. |
3个 |
D. |
4个 |
化学与生活、环境、能源、材料等密切相关。
(1)“垃圾分类,人人有责”。下列可回收垃圾的主要成分是有机合成材料的是 (填序号)。
A.废弃纸箱
B.塑料瓶
C.铝质易拉罐
(2)人们常用“84”消毒液对各场所进行消毒,它的有效成分是次氯酸钠(NaClO),分析次氯酸钠的构成,写出次氯酸的化学式 。
(3)在汽油中加入适量乙醇(C2H5OH)作为汽车燃料,可适当节省石油资源。请写出乙醇充分燃烧的化学方程式: 。
(4)2021年从三星堆出土了大量表面有一层“绿色物质”的青铜器,研究人员将“绿色物质”隔绝空气加热,发现它分解生成氧化铜、水和二氧化碳,由此得出组成“绿色物质”的元素有 (填元素符号)。
我国力争在2060年前实现"碳中和"(二氧化碳的排放与吸收平衡,实现"零排放"),保护环境。实现"碳中和"通常可采取如下措施:
(1)碳减排:使用氢能源汽车可以有效减少二氧化碳的排放。单质硼(B)可与物质X反应制取氢气,化学方程式为:2B+6X  2B(OH) 3+3H 2↑,则X的化学式为 ,B(OH) 3中B的化合价为 。
2B(OH) 3+3H 2↑,则X的化学式为 ,B(OH) 3中B的化合价为 。
(2)碳"捕捉"与封存:碳"捕捉"可用氢氧化钠溶液吸收空气中的二氧化碳,该反应的化学方程式为 。
(3)碳转化:一定条件下,可将二氧化碳在催化剂表面转化成某种有机清洁燃料,其反应原理如图所示,该反应的化学方程式为 。

试题篮
()