孔雀石的主要成分是Cu2(OH)2CO3,还含有Fe2O3、Al2O3、SiO2杂质,用该矿石制备Cu的流程如图所示(部分产物略去):
 (1)过程①中,操作a是溶解和 ,还有一种气体产物是 ,滤液X中含有的金属阳离子为 。
(1)过程①中,操作a是溶解和 ,还有一种气体产物是 ,滤液X中含有的金属阳离子为 。
(2)过程①中硫酸略过量,则过程②调pH除杂的最佳试剂是 (选填“CuO”或“Na2CO3”)。
(3)下列关于制取铜的两种方案的说法,正确的是 。
A.“方案一”得到的铜产品更纯
B.“方案一”不存在消耗能量的问题
C.“方案二”需考虑废气污染的问题
D.“方案二”得到纯铜的产率更高
(4)过程③发生的反应:2CuSO4+2H2O 2Cu+O2↑+ (补充完方程式),当收集到800t氧气时,产生Cu的质量是多少?(写出必要的计算过程)
2Cu+O2↑+ (补充完方程式),当收集到800t氧气时,产生Cu的质量是多少?(写出必要的计算过程)
生铁和钢都是铁和碳的合金,生铁含碳量为2%~4.3%,钢含碳量为0.03%~2%.化学兴趣小组的同学为确定该铁合金是生铁还是钢,他们取11.5g铁合金样品盛放到锥形瓶中,将100g稀盐酸分成5等份,分5次加入锥形瓶,每次待充分反应后记录实验数据。实验数据整理如下表所示:
| 次数 |
加盐酸前 |
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
| 加入稀盐酸的质量(g) |
0 |
20 |
20 |
20 |
20 |
20 |
| 锥形瓶内物质的总质量(g) |
11.5 |
31.4 |
m |
71.2 |
91.1 |
111.1 |
【查阅资料】碳不与稀盐酸反应。
请回答下列问题:
(1)根据质量守恒定律,该反应中生成气体的总质量为 。
(2)实验数据表中m的值为 。
(3)请通过计算确定该铁合金是生铁还是钢(写出计算过程,计算结果保留到0.1%)。
菱镁矿中主要含MgCO3、FeCO3和SiO2.以菱镁矿为原料制取镁的工艺流程如图。
回答下列问题:
(1)菱镁矿属于 (选填“纯净物”或“混合物”)。
(2)流程中滤渣a主要成分是 。
(3)写出菱镁矿中MgCO3与稀HCl反应的化学方程式 。
(4)溶液b→溶液c反应的化学方程式为:4FeCl2+ +4HCl=4FeCl3+2H2O(补充完方程式)
(5)溶液c调pH使Fe3+完全沉淀为Fe(OH)3从而与Mg2+分离,则调pH的范围应为2.8﹣ 。
已知:物质沉淀的pH见下表:
物质 |
Mg(OH)2 |
Fe(OH)3 |
开始沉淀的pH |
8.9 |
1.5 |
完全沉淀的pH |
10.9 |
2.8 |
(6)结合流程中的数据计算。
①菱铁矿中镁元素的质量分数为 (不考虑整个流程转化中的损失)。
②MgCl2通电制得的气体的质量(写出计算过程)。
将16g纯净物R在足量氧气中完全燃烧,生成44g二氧化碳和36g水。下列判断正确的是( )
| A. |
R只含碳、氢元素 |
| B. |
消耗氧气32g |
| C. |
R含碳、氢、氧三种元素 |
| D. |
R中碳元素的质量分数为70% |
下列说法正确的是( )
| A. |
某氧化钙和碳酸钙的混合物中钙元素的质量分数为60%,将50g该混合物高温煅烧至固体质量不再改变,剩余固体的质量是42g |
| B. |
120g 尿素[CO(NH 2) 2]与150g硝酸铵中氮元素的质量相等 |
| C. |
用含氧化铁85%的赤铁矿石160t,理论上可炼出含杂质3%的生铁80t |
| D. |
现有氢氧化钾和氯化钾的混合物20.5g,向其中加入100g质量分数为3.65%的稀盐酸,恰好完全反应,则原混合物中钾元素的质量为11.7g |
读图识图是学习化学的重要手段。下列四个图像中不能正确反映对应变化关系的是( )
A.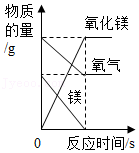 一定量的镁在过量氧气中充分燃烧
一定量的镁在过量氧气中充分燃烧
B. 加热分解一定质量的KMnO4固体
加热分解一定质量的KMnO4固体
C. 向一定质量的Cu(NO3)2溶液中加入铁粉
向一定质量的Cu(NO3)2溶液中加入铁粉
D. 向稀盐酸和MgCl2的混合溶液中滴加NaOH溶液
向稀盐酸和MgCl2的混合溶液中滴加NaOH溶液
小嘉发现:向碳酸钠溶液中倾倒稀盐酸,很快就产生了气泡:向碳酸钠溶液中逐滴加入稀盐酸,滴加一定量后才有气泡产生。查阅资料:向碳酸钠溶液中逐滴加入稀盐酸,先发生的反应是Na2CO3+HCl═NaCl+NaHCO3;当Na2CO3全部转化成NaHCO3后,再发生反应NaHCO3+HCl═NaCl+H2O+CO2↑。为此他用如图所示装置进行了如下实验:
步骤一:在广口瓶中加入10克溶质质量分数为10.6%的碳酸钠溶液,用注射器向瓶中缓慢注入一定量的溶质质量分数为7.3%的稀盐酸,观察到瓶内无明显现象; 步骤二:继续用注射器向瓶中注入稀盐酸,一段时间后观察到瓶内连续产生气泡,烧杯中澄清石灰水?。 |
(1)步骤二中,观察到烧杯中澄清石灰水 。
(2)上述实验中,加入稀盐酸多少克后,才开始产生二氧化碳? 。
(3)向一定量碳酸钠溶液中无论是倾倒还是逐滴加入足量的稀盐酸,完全反应后产生二氧化碳质量是相同的,其本质原因是什么? 。

以FeSO4•7H2O为原料制备铁红(Fe2O3)的一种方法如图:

已知“沉淀”时的主要反应为:2FeSO4+H2O2+2H2O═2FeO(OH)↓+2H2SO4
(1)FeO(OH)中铁元素的化合价为 。FeO(OH)可表示为mFe2O3•nFe(OH)3, 。
(2)“沉淀”时需控制溶液的pH与反应的温度。
①“沉淀”时调节溶液的初始pH约为4,过程中应始终保持溶液的pH为3.0~4.5,需不断加入物质Z调节溶液的pH,Z应具备的性质有 (填字母)。
A.能与酸反应
B.能与碱反应
C.不与FeO(OH)反应
②“沉淀”时反应温度不宜过高,其原因是 。
(3)“过滤”后需对固体进行洗涤与干燥。洗涤时被除去的沾于固体表面的阴离子为 (填离子符号)。
(4)“煅烧”时反应的化学方程式为 。
(5)如图为其他条件相同时不同煅烧温度对产品中Fe2O3质量分数的影响。煅烧温度较低时,产品中Fe2O3质量分数较低,其原因是 。当煅烧温度达800℃时,继续升高温度,产品中Fe2O3质量分数降低,且铁元素质量分数升高,所得产品发黑,其可能原因是 。

(6)用该方法制备Fe2O3,计算理论上13.9t FeSO4•7H2O(相对分子质量为278)可制得Fe2O3的质量(写出计算过程)。
2020年9月,中国向世界宣布了2030年前实现碳达峰、2060年前实现碳中和的目标。
(1)为减缓大气中二氧化碳含量的增加,下列措施可行的是 (填序号)。
A.植树造林,开发和利用太阳能、水能、风能等新能源
B.禁止使用煤、石油、天然气等化石燃料
(2)绿色植物通过光合作用吸收二氧化碳,生成葡萄糖并放出氧气,其反应的化学方程式:6CO2+6H2O 葡萄糖+6O2,则葡萄糖的化学式为 。若吸收44g二氧化碳,理论上可释放出氧气 g。
葡萄糖+6O2,则葡萄糖的化学式为 。若吸收44g二氧化碳,理论上可释放出氧气 g。
(3)近年我国科学家合成了一种新型催化剂,可将二氧化碳和氢气转化为清洁的液体燃料甲醇(CH3OH)和水,该反应的化学方程式为 。
(4)将一氧化碳和二氧化碳的混合气体3.2g通过足量灼热氧化铜粉末,充分反应,将所得的气体全部通入足量的氢氧化钡溶液中,气体全部被吸收,生成白色碳酸钡沉淀,溶液质量减少15.3g。则原混合气体中碳、氧元素的质量比为 (填最简比)。
如图所示四个图像对应的变化过程正确的是( )
A. 气体物质的溶解度与温度和压强的关系
气体物质的溶解度与温度和压强的关系
B. 浓硫酸长时间露置于空气中
浓硫酸长时间露置于空气中
C.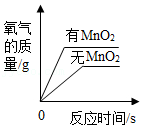 用等质量、等浓度的过氧化氢溶液分别制取氧气
用等质量、等浓度的过氧化氢溶液分别制取氧气
D.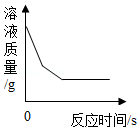 向足量的硫酸铜溶液中加入铁和镁固体混合物
向足量的硫酸铜溶液中加入铁和镁固体混合物
某工厂利用废铁屑与废硫酸反应制取绿矾(FeSO4•7H2O)。
(1)绿矾中铁原子与氧原子个数比为 。
(2)现有废硫酸4.9t(硫酸的质量分数为20%)与足量的废铁屑反应,理论上可生产出绿矾的质量是多少?(请写出计算过程,结果保留三位有效数字,下同)
(3)若配制100g质量分数为20%的稀硫酸溶液,需质量分数为98%的浓硫酸的体积是多少?(已知:质量分数为98%的浓硫酸的密度为1.84g/cm3)。
我国塑料购物袋的年消耗量很大,废弃塑料的处理亟待解决。回答下列问题。
(1)购物袋等塑料制品的大量使用,可能会造成的一种环境污染是 。
(2)小林尝试用焚烧法对某类塑料购物袋(主要成分是聚氯乙烯)进行处理,并将燃烧产物用氢氧化钠溶液进行吸收。
【查阅资料】Ⅰ.聚氯乙烯的化学式为(C2H3Cl)n。
Ⅱ.氯化氢气体会污染环境
Ⅲ.Na2CO3+CaCl2═CaCO3↓+2NaCl
①聚氯乙烯完全燃烧的化学方程式如下:
2(C2H3Cl)n+5nO2 4nCO2+2nHCl+2nX,则X的化学式为 。
②将完全燃烧后的产物,全部通入到一定量的NaOH溶液中,得到吸收液,写出氢氧化钠溶液吸收氯化氢的化学方程式 。
③小林对吸收液的溶质成分产生了兴趣,进行如下探究:
[提出问题]吸收液中溶质的成分是什么?
[进行实验1]取吸收液少许置于试管中,滴加2~3滴无色酚酞试液,发现酚酞变红色,说明溶液呈 性。
[猜想]猜想1:NaCl、NaOH、Na2CO3
猜想2:
猜想3:NaCl、Na2CO3、NaHCO3
猜想4:NaCl、NaHCO3
[进行实验2]向实验1所得溶液中,加入过量的CaCl2溶液,小林观察到 (填实验现象),最终得出结论:猜想1正确。
[交流反思]实验结束后,小林对吸收液进行无害化处理,其方案是 ,然后倒入废液缸。
咨询老师后,小林获悉废弃塑料的资源化回收是减少环境危害的最好方法。
(3)聚氯乙烯的生产需要用到氯气。工业上获取氯气的方法是电解饱和食盐水,发生反应的化学方程式为:2NaCl+2H2O 2NaOH+H2↑+Cl2↑.某工厂需生产14.2t氯气(Cl2),至少需要氯化钠的质量为多少?(请写出计算过程)
小苏打(NaHCO 3)是发酵粉的主要成分,可用于制作发面食品。化学兴趣小组为测定某品牌小苏打样品(含NaCl杂质)中碳酸氢钠的含量做了如下实验:将该样品17.1g放入锥形瓶中,加水全部溶解后,得到208.8g样品溶液,向该样品溶液中不断加入稀盐酸(如图),反应过程中锥形瓶中溶液质量的变化如下表所示。(忽略CO 2在水中的溶解)
| 加入稀盐酸的总质量/g |
25 |
50 |
75 |
| 锥形瓶中溶液的质量/g |
229.4 |
250 |
275 |
试计算:
(1)当加入25g稀盐酸时,产生二氧化碳的质量是 g。
(2)17.1g小苏打样品中NaHCO 3的质量(写出计算过程,下同)。
(3)当锥形瓶内样品溶液中的碳酸氢钠与加入的稀盐酸恰好完全反应时,锥形瓶中溶液的溶质质量分数。(计算结果精确至0.1%)

将CO和铁的氧化物FexOy置于密闭容器中,一定条件下充分反应至完全。反应过程中容器内部分物质的质量变化如图所示。下列说法正确的是( )
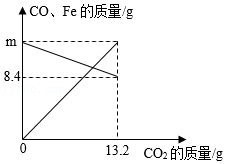
A.m的值为12.6
B.铁的氧化物中x:y=3:4
C.参加反应的铁的氧化物的质量为16g
D.当CO2质量为4.4g时,容器内CO质量为14g
试题篮
()