工业上电解饱和食盐水能制取多种化工原料,其中部分原料可用于制备多晶硅。
(1)上图是离子交换膜法电解饱和食盐水示意图,电解槽阳极产生的气体是________;NaOH溶液的出口为________(填字母);精制饱和食盐水的进口为________(填字母);干燥塔中应使用的液体是________。
(2)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注。
①SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为___________________________________。
②SiCl4可转化为SiHCl3而循环使用,一定条件下,在20 L恒容密闭容器中的反应:
3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g)
4SiHCl3(g)
达平衡后,H2和SiHCl3物质的量浓度分别为0.140 mol/L和0.020 mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为________kg。
(3)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气,现制得氯酸钠213.0 kg,则生成氢气________m3(标准状况)。
精细化学品具有品种多、批量少、产值高的特点。
(1)表面活性剂在工农业生产和日常生活中广泛应用,其优点是______________,能显著降低水与空气或其他物质的________,提高工业生产________,提高产品的________,故表面活性剂被称为_________________。
(2)在泡沫灭火器中添加表面活性剂可以提高灭火效果的原因是什么?
(3)精细化学品具有特定的功能,特殊的用途,如有些洗衣粉适用于洗衣机,加酶洗衣粉不能用于洗涤____________,医药和农药都有严格的________、__________等。
Ⅰ.工业上用铝土矿制取铝的流程如下: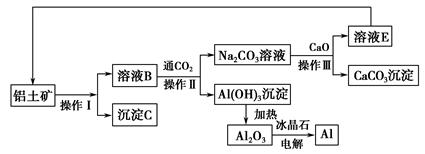
请回答下列问题:
(1)操作Ⅰ、操作Ⅱ、操作Ⅲ都用到的玻璃仪器有__________________________。
(2)写出由溶液B生成Al(OH)3的离子方程式:____________________________。
(3)工艺流程中涉及氧化还原反应的化学方程式为:_________________________。
(4)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有________(填化学式)。用此法制取铝的副产品是________(填化学式)。
Ⅱ.我国高炉生产各方面取得了显著进步,但在资源和能源利用率、高炉大型化、提高产业集中度以及环保等方面还跟国际存在很大差距,有待进一步提高,努力向钢铁强国迈进。请回答下列问题:
(1)高炉炼铁的原料有铁矿、焦炭和石灰石,其中起熔剂作用的是________,目的是除去铁矿石中的脉石,其产物密度比铁________,所以在铁水的________(填“上部”或“下部”)形成炉渣而与铁水分离。
(2)焦炭在高炉炼铁中起着举足轻重的作用,下列不属于焦炭作用的是________。
A.作为燃料,为炼铁中的化学反应提供能量
B.作为还原剂与二氧化碳反应产生还原氧化铁的一氧化碳
C.对高炉中的物料起到支撑和疏散的作用
D.作为溶剂,除去铁矿石中的杂质
(3)高炉炼铁的污染非常严重,目前我国部分大城市中的钢铁厂借着搬迁的机会也在进行着工艺改进。高炉炼铁导致的环境污染有________。
A.臭氧空洞 B.酸雨 C.一氧化碳毒害 D.沙尘暴
(4)写出高炉炼铁中与碳元素有关的氧化还原反应化学方程式:____________________________。
(5)从“三废”利用、环境保护等角度考虑,钢铁企业在生产中应采取的一些措施有(举出2种措施即可) _______________________________________。
多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有钙、铁、镁等离子)制备BaCl2·2H2O,工艺流程如图所示。已知常温下Fe3+、Mg2+完全沉淀的pH分别是3.4、12.4。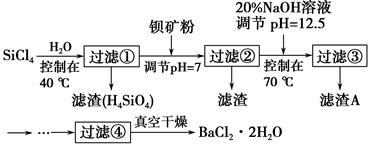
(1)SiCl4水解控制在40 ℃的原因是___________________________________。
已知:SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g) ΔH1=+47 kJ·mol-1
Si(s)+3HCl(g)=SiHCl3(s)+H2(g) ΔH2=-189 kJ·mol-1
则由SiCl4制备硅的热化学方程式为__________________________________。
(2)加钡矿粉时生成BaCl2的离子反应方程式是_________________________。
(3)加20% NaOH溶液调节pH=12.5,得到滤渣A的主要成分是________,控制温度70 ℃的目的是____________________________________________。
(4)BaCl2滤液经蒸发浓缩、降温结晶、过滤,再经真空干燥后得到BaCl2·2H2O。实验室中蒸发浓缩,用到的含硅酸盐的仪器有__________种。
(5)为体现该工艺的绿色化学思想,该工艺中能循环利用的物质是____________。
钢铁工业对促进经济和社会发展起了重要作用。
(1)炼铁高炉分为五部分,铁矿石与高温煤气主要在________部分发生反应,在________部分开始生成生铁和炉渣。
(2)炼钢时,除磷的化学方程式为____________________;加入硅、锰和铝的目的是________________________。
(3)不锈钢含有的Cr元素是在炼钢过程的氧吹________(填“前”或“后”)加入,原因是______________________。
(4)炼铁和炼钢生产中,尾气中均含有的主要污染物是________。从环保和经济角度考虑,上述尾气经处理可用作________。
下列有关生铁炼钢的叙述错误的是( )。
| A.添加必要的元素,改善钢材的组织结构和性能 |
| B.适当降低生铁中的含碳量,除去大部分硫、磷等杂质 |
| C.加入硅、锰、铝等合金元素调整成分并脱去钢水中的氧 |
| D.除去生铁中的非金属元素 |
工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)制取金属锌的流程如图所示。回答下列问题:
(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为
(2)净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转为Fe(OH)3沉淀。
①写出酸性条件下H2O2与Fe2+反应的离子方程式
②250C时,pH=3的溶液中,c (Fe3+)= mol/L(已知25℃, 。
。
③净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是 。
(3)若没有净化II操作,则对锌的制备带来的影响是 。
(4)本流程中可以循环利用的物质除锌外还有 。
硼、镁及其化合物在工农业生产中应用广泛。
已知:硼镁矿主要成分为Mg2B2O5•H2O,硼砂的化学式为Na2B4O7•10H2O。利用硼镁矿制取金属镁及粗硼的工艺流程为:
回答下列有关问题:
(1)硼砂中B的化合价为 ,溶于热水后,常用H2SO4调pH2~3制取H3BO3,反应的离子方程式为 。X为H3BO3晶体加热脱水的产物,其与Mg制取粗硼的化学方程式为 。
(2)MgCl2·7H2O需要在HCl氛围中加热,其目的是 。若用惰性电极电解MgCl2溶液,其阴极反应式为 。
(3)镁-H2O2酸性燃料电池的反应机理为Mg+H2O2+2H+==Mg2++2H2O,则正极反应式为 。若起始电解质溶液pH=1,则pH=2时溶液中Mg2+离子浓度为 。已知Ksp[Mg(OH)2]=5.6 10-12,当溶液pH=6时 (填“有”或“没有”)Mg(OH)2沉淀析出。
10-12,当溶液pH=6时 (填“有”或“没有”)Mg(OH)2沉淀析出。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将 0.020g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1 Na2S2O3(H2S2O3为弱酸)溶液滴定至终点,消耗Na2S2O3溶液18.00mL。盛装Na2S2O3溶液的仪器应为 滴定管(填“酸式”或“碱式”)。该粗硼样品的纯度为 。(提示:I2+2S2O32-=2I-+S4O62-)
用菱锰矿(MnCO3)常含有Fe2O3、FeO、HgCO3·2HgO等杂质,工业常用菱锰矿制取锰,工艺流程如下: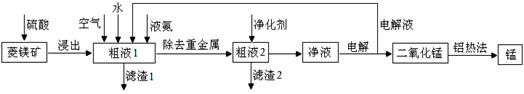
请回答下列问题:
(1)向粗液1中加入的水最后需要 方法才能达到技术要求。
(2)流程中用的空气是用膜分离法制备的富氧空气,该方法的原理是 。
(3)净化剂主要成分为(NH4)2S,粗液2中发生主要反应的离子方程式为 。
(4)写出阳极的电极反应式 。说明电解液循环的原因 。
(5)写出铝热法炼锰的化学方程式 。
碱式碳酸铜和氯气都是用途广泛的化工原料。
(1)工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl−)制备碱式碳酸铜,其制备过程如下:
已知:Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物质 |
Cu(OH)2 |
Fe (OH)2 |
Fe (OH)3 |
| 开始沉淀pH |
4.2 |
5.8 |
1.2 |
| 完全沉淀pH |
6.7 |
8.3 |
3.2 |
①氯酸钠的作用是 ;
②反应A后调节溶液的pH范围应为 。
③第一次过滤得到的产品洗涤时,如何判断已经洗净? 。
④造成蓝绿色产品中混有CuO杂质的原因是 。
(2)某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。
①实验室用二氧化锰和浓盐酸加热制取氯气,所用仪器需要检漏的有 。
②若C中品红溶液褪色,能否证明氯气与水反应的产物有漂白性,说明原因 。此时B装置中发生反应的离子方程式是___________ _____。
③写出A溶液中具有强氧化性微粒的化学式 。若向A溶液中加入NaHCO3粉末,会观察到的现象是 。
某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下:
(1)“酸浸”过程中主要反应的离子方程式为__________ 、____________。
(2)“酸浸”时铝浸出率的影响因素可能有_____ ________、_____ ______。(写出两个)
(3)物质X的化学式为___________。“碱溶”时反应的主要离子方程式为:Fe3++3OH- = Fe(OH)3↓; 。
(4)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4为了获得产品Al(OH)3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作过程是 。
(5)以煤矸石为原料还可以开发其他产品,例如在煤矸石的盐酸浸取液除铁后,常温下向AlCl3溶液中不断通入HCl气体,可析出大量AlCl3·6H2O晶体,结合化学平衡移动原理解释析出晶体的原因: 。
过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。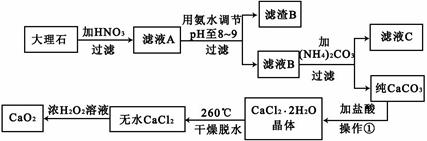
请回答下列问题:
(1)用氨水调节pH至8——9的目的是 。
(2)若测得滤液C中c(CO32-)=10-3mol/L,则Ca2+ (填“是”或“否”)沉淀完全。(已知c(Ca2+)≤10-5mol/L可视为沉淀完全;Ksp(CaCO3)=4.96×10-9)
(3)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,c(NH4+) c(NO3-)(填“≥”、“≤”、“<”、“>”或“=”)。
(4)在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式: ,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9——11,才出现大量沉淀。用化学方程式和简要的文字解释需用氢氧化钠调节pH至9——11的原因 。
实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程如下:

(1)根据图甲所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为________。图乙表示镍的浸出率与温度的关系,当浸出温度高于70 ℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是
________________________________________________________________。
(2)工艺流程中副产品的化学式为______________。
(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 |
Fe(OH)3 |
Fe(OH)2 |
Ni(OH)2 |
| 开始沉淀的pH |
1.5 |
6.5 |
7.7 |
| 沉淀完全的pH |
3.7 |
9.7 |
9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。请对该实验方案进行评价:_____________________________________________
(若原方案正确,请说明理由;若原方案错误,请加以改正)。
操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3molL-1,则Ca2+的浓度为________mol·L-1。(常温时CaF2的溶度积常数为2.7×10-11)
(5)电解产生2NiOOH·H2O的原理分两步:①碱性条件下Cl-在阳极被氧化为ClO-;②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。第②步反应的离子方程式为_______________________________________。
银铜合金广泛用于航空工业,从切割废料中回收银并制备铜化工产品的工艺如下:
(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450 ℃和80 ℃。)
(1)电解精炼银时,阴极反应式为________;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学反应方程式为________________。
(2)固体混合物B的组成为__________;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为____________。
(3)完成煅烧过程中一个反应的化学方程式:
CuO+____Al2O3 ____CuAlO2+________↑。
____CuAlO2+________↑。
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0 kg废料中的铜可完全转化为________ mol CuAlO2,至少需要1.0 mol·L-1的Al2(SO4)3溶液________ L。
(5)CuSO4溶液也可用于制备胆矾,其基本操作是________、过滤、洗涤和干燥。
用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下:
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
(1)H2SO4溶解Al2O3的离子方程式是___________________________________
_________________________。
(2)将MnO4—氧化Fe2+的离子方程式补充完整:42—
(3)已知:生成氢氧化物沉淀的pH
| |
Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
| 开始沉淀时 |
3.4 |
6.3 |
1.5 |
| 完全沉淀时 |
4.7 |
8.3 |
2.8 |
注:金属离子的起始浓度为0.1 mol·L-1。
根据表中数据解释步骤Ⅱ的目的____________________________________。
(4)已知:一定条件下,MnO4—可与Mn2+反应生成MnO2。
①向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是
_________________________________________________________________。
②Ⅳ中加入MnSO4的目的是______________________________________。
试题篮
()