磁材氧化铁的化学名称是氧化铁(Fe2O3),它是电子、电信工业的磁性材料,工业上采用生产钛白粉的下脚料(含大量FeSO4的废液)为原料来制备磁材氧化铁。

已知:煅烧中的化学反应方程式为:FeCO3 → FeO + CO2↑,4FeO + O2 → 2Fe2O3
(1)用98%的H2SO4的配制500mL的20%的H2SO4,所需玻璃仪器是
| A.玻璃棒 | B.烧杯 | C.漏斗 | D.250mL容量瓶 |
E.500mL容量瓶 F.胶头滴管
(2)浓缩结晶后得到的晶体是 (填化学式),A中溶质是 ;此溶液中各
离子的浓度比较大小为: 。
(3) 20%H2SO4和铁皮的作用分别是 。
(4)检验滤液中含有NH4+的方法是 。
(5)写出步骤“合成”中发生的化学变化(用化学方程式表示): 。
废旧显示屏玻璃种含有SiO2、Fe2O3、CeO2、FeO等物质。某课题小组以此玻璃粉末为原料,制得Ce(OH)4和硫酸铁铵矾[Fe2(SO4)3·(NH4)2SO4·24H2O],流程设计如下:
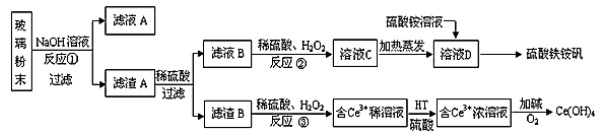
已知:Ⅰ.酸性条件洗,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce4+有较强氧化性;
Ⅱ.CeO2不溶于稀硫酸,也不溶于氢氧化钠溶液。
回答以下问题:
(1)反应②中过氧化氢的作用是 。
(2)反应③的离子方程式是 。
(3)已知有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为:
2 Ce3+(水层)+6HT(有机层) ≒2 CeT3 (有机层) +6H+(水层)
从平衡角度解释:向CeT3(有机层)加入硫酸获得较纯的含Ce3+的水溶液的原因是 。
(4)硫酸铁铵矾[Fe2(SO4)3·(NH4)2SO4·24H2O]广泛用于水的净化处理,其净水原理用离子方程式解释是 。
(5)相同物质的量浓度的以下三种溶液中,铵根离子浓度由大到小的顺序是 。
a.Fe2(SO4)3·(NH4)2SO4·24H2O b.(NH4)2SO4 c.(NH4)2CO3
(6)用滴定法测定制得的Ce(OH)4产品纯度。

若所用硫酸亚铁溶液在空气中露置一段时间后再进行滴定,则测得该Ce(OH)4产品的质量分数 。(填“偏大”、“偏小”或“无影响”);称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量氢氧化钠溶液,过量洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/L硝酸钡溶液100mL,恰好完全反应。则该硫酸铁铵的化学式为 。
(15分)铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得.
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如图1所示:
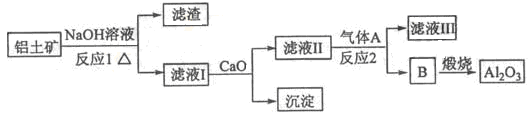
图1

图2
②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如图2所示:
回答下列问题:
(1)写出反应1的化学方程式 ; 。
(2)滤液Ⅰ中加入CaO生成的沉淀是______,反应2的离子方程式为______;
(3)E可作为建筑材料,化合物C是______,写出由D制备冰晶石的化学方程式______;
(4)电解制铝的化学方程式是______,以石墨为电极,阳极产生的混合气体的成分是______。
活性ZnO俗称锌白,能改进玻璃的化学稳定性,可用于生产特种玻璃。工业上由粗锌ZnO(含FeO、CuO等)制备ZnO,采取酸浸入、净化除杂、中和沉淀、干燥等步骤,工艺如下:

(1)该流程中物质X可以是下列中的 ( )
| A.ZnO | B.NaOH | C.Zn(OH)2 | D.Na2CO3 |
(2)已知ZnO为两性氧化物,与氢氧化钠溶液反应可生成可溶性的锌酸盐(ZnO22-),写出反应的离子方程式 ;
(3)写出加入H2O2时发生反应的离子方程式 ;
(4)加入Zn后,过滤所得的滤渣有 ;
(5)上述流程中多次用到了过滤操作,请写出过滤时用到的玻璃仪器: ;
(6)检验滤液A中溶质的阴离子的方法是 。
(7)取碱式碳酸锌水合物6.82g,溶于盐酸中生成二氧化碳448mL(标况下),溶解过程消耗氯化氢0.12摩尔,若该碱式盐中氢元素的质量分数为1.76%,试推测该碱是碳酸锌水合物的化学式是 。
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
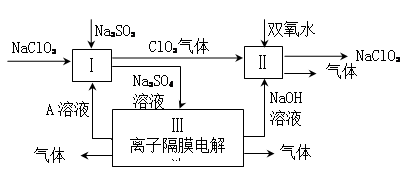
(1)Ⅰ、Ⅲ中发生反应的还原剂分别是 、 (填化学式)。
(2)Ⅱ中反应的离子方程式是 。
(3)A的化学式是 ,装置Ⅲ中A在 极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。写出该制备反应的化学方程式 。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量 。(填“相同”,“不同”或“无法判断”)
二氧化锗一般由四氯化锗水解制得,被广泛用于制作高纯金属锗、化工催化剂及电子器件等。现以含锗烟尘(主要含GeO2、SiO2和ZnO)为原料可制备GeO2,其工艺流程图如下:

已知;GeO2是两性氧化物;GeCl4易水解,沸点为86.6 ℃。
(1)第①步滤渣的主要成分有_ (填化学式),第④步操作所需的玻璃仪器为锥形瓶、牛角管、温度计、酒精灯、冷凝管和_ 。
(2)第③步萃取时,锗的萃取率与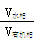 (水相和有机相的体积比)的关系如图所示,从生产成本角度考虑,较适宜的
(水相和有机相的体积比)的关系如图所示,从生产成本角度考虑,较适宜的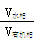 的值为_ 。
的值为_ 。

(3)第④步加入盐酸的作用_ (答两点即可)。
(4)第⑤步反应的化学方程式是_ 。
(5)检验GeO2·nH2O是否洗涤干净的操作是_
辉铜矿是冶炼铜的重要原料。
(1)工业上冶炼粗铜的某种反应为:Cu2S+O2=2Cu+SO2①当产生标况下11.2L气体时,转移电子数目为 ;
②将粗铜进行电解精炼,粗铜应与外电源的 极相接;若精炼某种仅含杂质锌的粗铜,通电一段时间后测得阴极增重ag,电解质溶液增重bg,则粗铜中含锌的质量分数为 ;
(2)将辉铜矿、软锰矿做如下处理,可以制得碱式碳酸铜:

① 步骤I中用稀硫酸浸取矿石,为提高浸取率可采取的措施有 (任写一种)。
② 步骤Ⅱ中调节浸出液pH=3.5的作用是 ;
③ 步骤Ⅰ中发生如下3个反应,已知反应Ⅰ中生成的硫酸铁起催化作用。请写出反应Ⅲ的化学方程式。
Ⅰ.Fe2O3+3H2SO4 = Fe2(SO4)3+3H2O
Ⅱ.Cu2S+ Fe2(SO4)3 = CuSO4+CuS+2FeSO4
Ⅲ. 。
④步骤Ⅱ中,碳酸氢铵参与反应的离子方程式为 。
下列物质与其用途完全符合的有( )
①Na2CO3—制玻璃; ②SiO2—太阳能电池; ③Na2SiO3—木材防火剂; ④NH3—制冷剂;
⑤Al2O3—焊接钢轨; ⑥NaClO—消毒剂、漂白织物 ⑦Fe2O3—红色油漆或涂料
| A.4个 | B.5个 | C.6个 | D.7个 |
镍是有机合成的重要催化剂。某化工厂有含镍催化剂废品(主要成分是镍,杂质是铁、铝单质及其化合物,少量难溶性杂质)。某学习小组设计如下流程利用含镍催化剂废品制备硫酸镍晶体:

几种难溶碱开始沉淀和完全沉淀的pH:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Ni(OH)2 |
| 开始沉淀 |
3.8 |
2.7 |
7.6 |
7.1 |
| 完全沉淀 |
5.2 |
3.2[来 |
9.7 |
9.2 |
回答下列问题:
(1)溶液①中含有金属的离子是 。
(2)用离子方程式表示加入双氧水的目的 。
(3)操作b调节溶液范围为3.2~7.1,其目的是 ,固体②的化学式为 。
(4)操作a和c需要共同的玻璃仪器是 。上述流程中,防止浓缩结晶过
程中Ni2+水解的措施是 。
(5)如果加入双氧水量不足或“保温时间较短”,对实验结果的影响是 。
设计实验证明产品中是否含“杂质”: 。(不考虑硫酸镍影响)
(6)取2.000 g硫酸镍晶体样品溶于蒸馏水,用0.2000 mol•L-1的EDTA(Na2H2Y)标准溶液滴定至终点,消耗EDTA标准溶液为34.50 mL。反应为Ni2++H2Y2-=NiY2-+2H+。计算样品纯度为 。(已知,NiSO4•7H2O相对分子质量为281,不考虑杂质反应)。
某化学兴趣小组设计如下流程,从酸性工业废液(含H+、A13+、Mg2+、Cr3+、SO42-)中提取铬。

有关数据如下表:

回答下列问题:
(1)步骤①所得滤液可用于制取MgSO4·7H2O,酸性工业废液中加入适量氧化铝的作用是_ ___。
(2)若酸性废液中c(Mg2+)=0.lmol·L-l,为达到步骤①的实验目的,则废液的pH应保持在 范围(保留小数点后l位)。
(3)步骤②中生成NaCrO2的离子方程式为___ _ 。
(4)步骤④中反应的离子方程式为_____ 。
(5)步骤⑤在空气中充分灼烧的目的是 ,可选用的装置是__________(填序号)。

(6)用如图所示装置制取铬酸钠(Na2CrO4),回答相关问题。
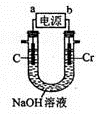
①a是电源的_____________极,阳极的电极反应式为______________。
②若电解一段时间后阴极收集到标准状况下的气体3.36 L,则理论上可制得___________g铬酸钠(忽略反应2CrO42-(aq)+ 2H+(aq) Cr2O72-(aq)+ H2O(1)的影响)
Cr2O72-(aq)+ H2O(1)的影响)
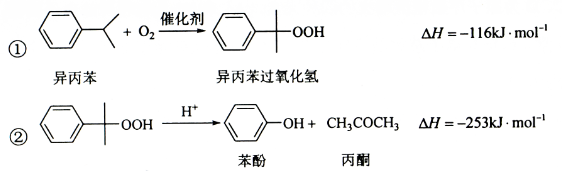
苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下:

相关化合物的物理常数
| 物质 |
相对分子质量 |
密度(g/cm-3) |
沸点/℃ |
| 异丙苯 |
120 |
0.8640 |
153 |
| 丙酮 |
58 |
0.7898 |
56.5 |
| 苯酚 |
94 |
1.0722 |
182 |
回答下列问题:
(1)在反应器A中通入的X是 。
(2)反应①和②分别在装置 和 中进行(填装置符号)。
(3)在分解釜C中加入的Y为少置浓硫酸,其作用是______,优点是用量少,缺点是_____。
(4)反应②为(填“放热”或“吸热”)反应。反应温度控制在50-60℃,温度过高的安全隐患 是 。
(5)中和釜D中加入的Z最适宜的是 (填编号。已知苯酚是一种弱酸)
A. NaOH B. CaCO C. NaHCO D. CaO
(6)蒸馏塔F中的馏出物T和P分别为 和 ,判断的依据是 。
(7)用该方法合成苯酚和丙酮的优点是 。
锂离子电池的应用很广,其正极材料可再生利用。某锂离子电池正极材料有钴酸锂(LiCoO2)、导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为6C+xLi++xe- = LixC6。现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)。
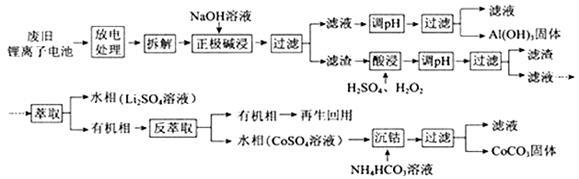
回答下列问题:
(1)LiCoO2中,Co元素的化合价为 。
(2)写出“正极碱浸”中发生反应的离子方程式 。
(3)“酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式 ;可用盐酸代替H2SO4和H2O2的混合液,但缺点是 。
(4)写出“沉钴”过程中发生反应的化学方程式 。
(5)充放电过程中,发生LiCoO2与Li1-xCoO2之间的转化,写出放电时电池反应方程式 。
(6)上述工艺中,“放电处理”有利于锂在正极的回收,其原因是 。在整个回收工艺中,可回收到的金属化合物有 (填化学式)。
硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡[Sn(OH)Cl]。
回答下列问题:
(1)锡元素在周期表中位于第五周期,与碳元素位于同一主族,则锡元素的原子的核电荷数为_______。
(2)操作Ⅰ是_________、冷却结晶________、洗涤、干燥。。
(3)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因___________________________。
(4)加入Sn粉的作用有两个:①调节溶液pH,②__________________________。
(5)酸性条件下,SnSO4还可以作双氧水去除剂,发生反应的离子方程式是___________。
(6)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl=SnCl2 + H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:
6FeCl2 + K2Cr2O7 + 14HCl =6FeCl3 + 2KCl + 2CrCl3 +7H2O
取1.19g 锡粉,经上述各步反应后,共用去0.100 mol/L K2Cr2O7溶液32.0 ml。锡粉中锡的质量分数是___________________。
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:

(1)MgCO3与稀硫酸反应的离子方程式为 。
(2)加入H2O2氧化时,发生反应的化学方程式为 。
(3)滤渣2的成分是 (填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C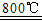 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C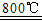 MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C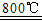 MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。

①D中收集的气体可以是 (填化学式)。
②B中盛放的溶液可以是 (填字母)。
a、NaOH溶液 b、Na2CO3溶液 c、稀硝酸 d、KMnO4溶液
③ A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式: 。
硼镁泥主要成份是MgO(占35%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质。从硼镁泥中提取MgSO4·7H2O的流程如下:

已知:NaClO与Mn2+反应产生MnO2沉淀.
| 沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
| 开始沉淀pH |
2.3 |
4.0 |
7.6 |
| 完全沉淀pH |
4.1 |
5.2 |
9.6 |
根据题意回答第(1)~(5)题:
(1)在酸解过程中,欲加快酸解时的化学反应速率,请提出两种可行的措施: 、 。
(2)加入的NaClO可与Mn2+反应:Mn2+ + ClO- + H2O = MnO2↓ + 2H+ + Cl-,还有一种离子也会被NaClO氧化,并发生水解,该反应的离子方程式为 。
(3)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有 。
(4)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) |
40 |
50 |
60 |
70 |
| MgSO4 |
30.9 |
33.4 |
35.6 |
36.9 |
| CaSO4 |
0.210 |
0.207 |
0.201 |
0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤是蒸发浓缩, 。“操作I”是将滤液继续蒸发浓缩,冷却结晶, __________ ,便得到了MgSO4·7H2O。
(5)实验中提供的硼镁泥共100 g,得到的MgSO4·7H2O为172.2 g,计算MgSO4·7H2O的产率为 。
试题篮
()