红磷和
发生反应生成
和
。反应过程和能量关系如图所示(图中的
表示生成1
产物的数据)。

根据上图回答下列问题:
(1)和
反应生成
的热化学方程式。
(2)分解成
和
的热化学方程式,上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80
,反应达到平衡时
还剩0.60
,其分解率
等于;若反应温度由
升高到
,平衡时
的分解率为
,
(填"大于"、"小于"或"等于")。
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物,然后降温,再和
反应生成
。原因是。
(4)和
分两步反应生成1
的
=,
和
一步反应生成1
的
(填"大于"、"小于"或"等于")。
(5)与足量水充分反应,最终生成两种酸,其化学方程式是。
已知: ΔΗ=234.1kJ·mol-1
ΔΗ=-393.5 kJ·mol-1
则 的ΔΗ是()
| A. | -824.4 kJ·mol -1 | B. | -627.6 kJ·mol -1 |
| C. | -744.7 kJ·mol -1 | D. | -169.4 kJ·mol -1 |
右图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混和,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块是
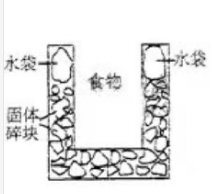
| A. | 硝酸铵 | B. | 生石灰 |
| C. | 氯化镁 | D. | 食盐 |
下列叙述不正确的是()
| A. | 铁表面镀锌,铁作阳极 |
| B. | 船底镶嵌锌块,锌作负极,以防船体被腐蚀 |
| C. |
钢铁吸氧腐蚀的正极反应:
|
| D. |
工业上电解饱和和食盐水的阳极反应:
|
 请回答氯碱的如下问题:
请回答氯碱的如下问题:
 (1)氯气、烧碱是电解食盐水时按照固定的比率
(1)氯气、烧碱是电解食盐水时按照固定的比率(质量比)生成的产品。理论上
=要求计算表达式和结果);
 (2)原料粗盐中常含有泥沙和
(2)原料粗盐中常含有泥沙和等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①
、②
(盐酸)③
,这3种试剂添加的合理顺序是(填序号)
 (3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
 ①
①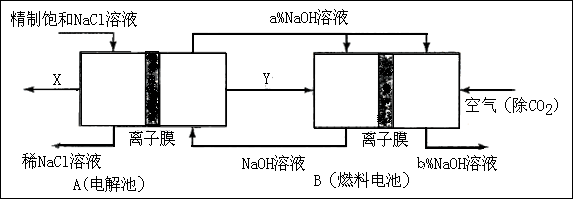
图中分别是、(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小;
 ②分别写出燃料电池
②分别写出燃料电池中正极、负极上发生的电极反应正极:; 负极:;
 ③这样设计的主要节(电)能之处在于(写出2处)、。
③这样设计的主要节(电)能之处在于(写出2处)、。
干电池应用广泛,其电解质溶液是
混合溶液。
 (1)该电池的负极材料是。电池工作时,电子流向(填"正极"或"负极")。
(1)该电池的负极材料是。电池工作时,电子流向(填"正极"或"负极")。
 (2)若
(2)若混合溶液中含有杂质
,会加速某电极的腐蚀,其主要原因是。欲除去
,最好选用下列试剂中的(填代号)。

.
.
.
.
(3)的生产方法之一是以石墨为电极,电解酸化的
溶液。阴极的电极反应式是
 。若电解电路中通过2
。若电解电路中通过2电子,
的理论产量为。
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
 (1)合成氨反应反应
(1)合成氨反应反应
,若在恒温、恒压条件下向平衡体系中通入氩气,平衡移动(填"向左""向右"或"不");,使用催化剂反应的
(填"增大""减小"或"不改变")。
 (2)
(2)
 则反应
则反应的
=
。
 (3)在25℃下,向浓度均为0.1
(3)在25℃下,向浓度均为0.1的
和
混合溶液中逐滴加入氨水,先生成沉淀(填化学式),生成该沉淀的离子方程式为。已知25℃时
=1.8×10-11,
=2.2×10-20。
 (4)在25℃下,将
(4)在25℃下,将的氨水与0.01
的盐酸等体积混合,反应平衡时溶液
则溶液显性(填"酸""碱"或"中");用含
的代数式表示
的电离常数
=。
 新型锂离子电池在新能源的开发中占有重要地位。可用作节能环保电动汽车的动力电池。磷酸亚铁锂(
新型锂离子电池在新能源的开发中占有重要地位。可用作节能环保电动汽车的动力电池。磷酸亚铁锂()是新型锂离子电池的首选电极材料,它的制备方法如下:
 方法一:将碳酸锂、乙酸亚铁[
方法一:将碳酸锂、乙酸亚铁[]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
 方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。
 在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子选移的介质,该有机聚合物的单体之一(用
在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子选移的介质,该有机聚合物的单体之一(用表示)的结构简式如下:


 请回答下列问题:
请回答下列问题:
 (1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原因是。
(1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原因是。
 (2)在方法一所发生的反应中,除生成磷酸亚铁锂、乙酸外,还有、
(2)在方法一所发生的反应中,除生成磷酸亚铁锂、乙酸外,还有、 、(填化学式)生成。
、(填化学式)生成。
 (3)在方法二中,阳极生成磷酸亚铁锂的电极反应式为
(3)在方法二中,阳极生成磷酸亚铁锂的电极反应式为 。
。
 (4)写出M与足量氧化钠溶液反应的化学方程式:
(4)写出M与足量氧化钠溶液反应的化学方程式: 。
。
 (5)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为。
(5)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为。
25 ℃,101 时,强酸与强碱的稀溶液发生中和反应的中和热为57.3
,辛烷的燃烧热为5518
。下列热化学方程式书写正确的是()

| A. |
|
B. |
|
C. |
|
| D. |
|
E. |
|
F. |
|
| G. |
|
H. |
|
I. |
|
| J. |
|
K. |
|
L. |
|
氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:


(1)氢氧燃料电池的能量转化主要形式是,在导线中电子流动方向为(用表示)。
 (2)负极反应式为。
(2)负极反应式为。
 (3)电极表面镀铂粉的原因为。
(3)电极表面镀铂粉的原因为。
 (4)该电池工作时,
(4)该电池工作时,和
连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下
 Ⅰ.
Ⅰ.
 Ⅱ.
Ⅱ.↑
 ①反应Ⅰ中的还原剂是,反应Ⅱ中的氧化剂是。
①反应Ⅰ中的还原剂是,反应Ⅱ中的氧化剂是。
 ②已知
②已知固体密度为0.82
。用锂吸收224
(标准状况)
,生成的
体积与被吸收的
体积比为。
 ③由②生成的
③由②生成的与
作用,放出的
用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为
。
下列热化学方程式数学正确的是(的绝对值均正确)
| A. |
|
| B. |
|
| C. |
|
| D. |
|
以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。
关于该电池的叙述正确的是:
| A.该电池能够在高温下工作 |
| B.电池的负极反应为:C6H12O6+6H2O-24e-=6CO2+24H+ |
| C.放电过程中,H+从正极区向负极区迁移 |
| D.在电池反应中,每消耗1mol氧气,理论上能生成标准状况下 |
CO2 22.4/6 L
废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是(填字母)
| A. | 热裂解形成燃油 | B. | 露天焚烧 |
| C. | 作为有机复合建筑材料的原料 | D. | 直接填埋 |
(2)用和
的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
在溶液中Cu 与
反应生成Cu2+和H2O的热化学方程式为:。
(3)控制其它条件相同,印刷电路板的金属粉末用10% 和3.0
溶液处理,测得不同温度下铜的平均溶解速率(见下表)
| 温度( |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
| 铜的平均溶解速率 (×10-3 |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是。
(4)在提纯后的溶液中加入一定量的
和
溶液,加热,生成
的离子方程式是。
有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是( )
①每消耗1molCH4可以向外电路提供8mole-
②负极上CH4失去电子,电极反应式CH4+10OH--8e-=CO32-+7H2O
③负极上是O2获得电子,电极反应式为O2+2H2O+4e-=4OH-
④电池放电后,溶液PH不断升高
| A.①② | B.①③ | C.①④ | D.③④ |
试题篮
()