在四个不同的容器中进行合成氨的反应。根据下列在相同时间内测定的结果,判断生成氨的速率最快的是
| A.v (N2)=0.05mol·L-1·s-1 | B.v (H2)=0.3mol·L-1·min-1 |
| C.v (N2)="0.2" mol·L-1·min-1 | D.v (NH3)="0.3" mol·L-1·min-1 |
维生素C(分子式为C6H8O6)具有较强的还原性,放置在空气中易被氧化,其含量可通过在弱酸性溶液中用已知溶液的I2溶液进行滴定。该反应的化学方程式如下:
C6H8O6+I2 C6H6O6+2HI
C6H6O6+2HI
现欲测定某样品中维生素C的含量,具体的步骤及测得的数据如下。取10mL 6mol·L-1CH3COOH,加入100mL蒸馏水,将溶液加热煮沸后放置冷却。精确称取0.2000g样品,溶解于上述冷却的溶液中,加入1mL淀粉指示剂,立即用浓度为0.05000mol·L-1的I2溶液进行滴定,直至溶液中的蓝色持续不褪为止,共消耗21.00mLI2溶液。
(1)为何加入的CH3COOH稀溶液要先经煮沸、冷却后才能使用?
(2)计算样品中维生素C的质量分数。
已知0.02 mol·L-1CH3COOH溶液和0.01 mol·L-1NaOH溶液以等体积混和后溶液呈酸性,则该混合液中微粒浓度关系正确的 ( )
| A.c (CH3COO-)>c (Na+) |
| B.c (Na+) + c (H+) =c (OH-) +c (CH3COOH)+c (CH3COO-) |
| C.c (CH3COOH)>c (CH3COO-) |
| D.c (CH3COOH)+c (CH3COO-)="0.02" mol·L-1 |
按要求写化学方程式:
(1)NaHCO3的电离方程式:_________________________________________________。
(2)NH4Cl水解的离子方程式:______________________________________________。
(3)AgCl沉淀的溶解平衡:_________________________________________________。
某盐的混合物中含有0.2 mol Na+、0.4 mol Mg2+、0.4 mol Cl -,则SO42- 为( )
| A.0.1 mol | B.0.3 mol | C.0.5 mol | D.0.15 mol |
下列溶液中,Na+ 浓度最大的是( )
| A.1mol/L Na2SO4溶液200mL | B.0.9mol/L Na3PO4溶液200mL |
| C.2.5mol/L NaOH 溶液100mL | D.1mol/L NaHCO3溶液300mL |
关于2molCO2的叙述,正确的是 (相对原子质量 C—12 O—16)
| A.质量为88g | B.摩尔质量为88g/mol |
| C.分子数为1.204×1024个 | D.常温下,体积为44.8L |
有关物质的量的计算。
(1)有NaCl、CaCl2、AlCl3三种溶液,若溶质的物质的量相等,分别与足量的硝酸银溶液反应,则生成沉淀的物质的量之比为________________.若生成的沉淀的质量相等,则三种溶液中溶质的物质的量之比为__________。
(2)相同质量的SO2和SO3,所含分子的数目之比为_________;所含O的物质的量之比为________。
(3)下列各物质所含原子数目,按由大到小顺序排列的是
①0.5mol NH3 ②标准状况下22.4L He ③4℃9mL水 ④0.2mol H3PO4
下列溶液中Cl-浓度最大的是( )
| A.10mL 0.2mol/L的FeCl3溶液 | B.30mL 0.25mol/L的FeCl2溶液 |
| C.20mL 0.2mol/L的KCl溶液 | D.10mL 0.3mol/L的AlCl3溶液 |
已知难溶电解质在水溶液中存在溶解平衡:
MmAn(s) 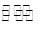 mMn+(aq)+nAm-(aq)
mMn+(aq)+nAm-(aq)
Ksp=[c(Mn+)]m×[c(Am-)]n 称为溶度积。
某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料:(25℃)
| 难溶电解质 |
CaCO3 |
CaSO4 |
MgCO3 |
Mg(OH)2 |
| Ksp |
2.8×10-9 |
9.1×10-6 |
6.8×10-6 |
1.8×10-12 |
实验步骤如下:
①往100 mL 0.1 mol·L-1的CaCl2溶液中加入100 mL 0.1 mol·L-1的Na2SO4溶液,立即有白色沉淀生成。
②向上述悬浊液中加入固体Na2CO3 3 g,搅拌,静置,沉淀后弃去上层清液。
③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液。
④_____________________________________________________________________。
(1)由题中信息知Ksp越大,表示电解质的溶解度越 (填“大”或“小”)。
(2)写出第②步发生反应的化学方程式:______________________________________。
(3)设计第③步的目的是___________________________________________________。
(4)请补充第④步操作及发生的现象: _____。
叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是
| A.HN3水溶液中微粒浓度大小顺序为:c(HN3) >c(N3¯)>c(H+)>c(OH¯) |
| B.HN3与NH3作用生成的叠氮酸铵是离子化合物 |
| C.NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3¯) >c(OH¯)>c(H+) |
| D.N3¯与CO2含相等电子数 |
已知某温度下0.1 moL/L的NaHB溶液中c(H+)>c(OH-),则下列关系式一定正确的是
| A.c(H+)+c(Na+)=c(HB-)+c(B2-)+c(OH-) | B.c(Na+)="0.1" moL/L≥c(B2-) |
| C.c(H+)×c(OH-)=1×10-14 | D.溶液的pH = 1 |
某种一元强碱MOH溶液加入一种一元酸HA反应后,溶液呈中性,下列判断一定正确的是
| A.加入的酸过量 | B.生成的盐不水解 |
| C.酸和碱等物质的量混合 | D.反应后溶液中c(A-)=c(M+) |
下列说法不正确的是( )
| A.pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7 |
| B.将等体积pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸所需加入的水量多 |
| C.向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:c(NH4+) = c(Cl-) |
| D.0.2 mol·L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+) |
下列有关溶液中微粒的物质的量浓度关系正确的是
| A.某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-) |
| B.物质的量浓度相等的①NH4HCO3溶液、②NH4Cl溶液、③NH4HSO4溶液中,c(NH4+)的大小关系:①>②>③ |
| C.0.1 mol·L-1 CH3COONa 溶液与0.05 mol·L-1盐酸等体积混合后的酸性溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
| D.0.1mol·L-1(NH4)2Fe(SO4)2溶液中: c(NH4+)+ c(NH3·H2O) + c(Fe2+)="0.3" mol·L-1 |
试题篮
()