同浓度的下列溶液中NH4+的浓度的由大到小顺序为
①NH4HSO4 ②(NH4)2SO4 ③(NH4)2Fe(SO4) ④NH4HCO3 ⑤(NH4)2CO3
用物质的量都是0.1 mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中C(CH3COO-)>C(Na+),对该混合溶液的下列判断正确的是( )
| A.C(H+)>C(OH-) | B.C(CH3COOH)+C(CH3COO-)=0.2 mol/L |
| C.C(CH3COOH)>C(CH3COO-) | D.C(CH3COO-)+C(OH-)=0.2 mol/L |
在0.1 mol/l的NH3·H2O溶液中,下列关系正确的是
| A.C(NH3·H2O)>C(OH-)>C(NH4+)>C(H+) | B.C(NH4+)>C(NH3·H2O)>C(OH-)>C(H+) |
| C.C(NH3·H2O)>C(NH4+)=C(OH-)>C(H+) | D.C(NH3·H2O)>C(NH4+)>C(H+)>C(OH-) |
某碱性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是( )
| A.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈蓝色 |
| B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成 |
| C.在NaOH溶液中加入一定量的CH3COOH溶液,只有当溶液中离子浓度满足: c(Na+)>c(CH3COO-)>c(OH-)>c(H+)时,才符合题意。 |
| D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH4+)之和 |
下列关于电解质溶液的叙述正确的是 ( )
A.常温下,Ph=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为:   |
B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
C.室温下,CH3COOH分子可存在于pH=8的碱性溶液中 |
D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 |
将等浓度的K2S溶液和NaHSO4溶液等体积混合,得到的溶液中离子浓度关系正确的是
A.c(K+)>c(Na+)>c(H+)>c(OH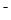 ) ) |
B.c(Na+)+c(K+)+c(H+)=c(SO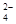 )+c(HS )+c(HS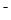 )+c(OH )+c(OH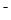 )+c(S2一) )+c(S2一) |
C.c(SO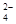 )>c(HS )>c(HS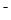 )>c(OH )>c(OH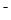 )>c(H+) )>c(H+) |
D.c(K+)=c(S2一)+c(H2S)+c(HS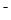 )+c(SO )+c(SO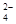 ) ) |
关于“电解氯化铜溶液时的pH变化”问题,化学界有以下两种不同的观点:观点一:“理论派”认为电解氯化铜溶液后溶液的pH升高。观点二:“实验派”经过反复、多次、精确的实验测定,证明电解氯化铜溶液时pH值的变化如右图曲线关系。请回答下列问题: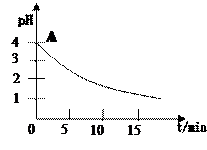
①电解前氯化铜溶液的pH值处于A点位置的原因是: (用离子方程式说明)。
②“理论派”所持观点的理论依据是: 。
③“实验派”的实验结论是 ,他们所述“精确实验”是通过
确定的。
④你持何种观点?你所持观点的理由是(从化学原理加以简述) 。
:已知一种c(H+)=1×10-3mol·L-1的酸和一种c(OH— )= 1×10-3 mol· L-1碱溶液等体积混合后,溶液呈酸性。其原因可能是 ( )
A.浓的强酸和稀的强碱溶液反应 B.浓的弱酸和稀的强碱溶液反应
C.等浓度的强酸和弱碱溶液反应 D.生成了一种强酸弱碱盐
分析:题中两溶液中的c(H+)= c(OH— ),采用中和假想法,若是强酸强碱等体积混合,溶液一定呈中性。现溶液呈酸性,说明酸过量,且必须是弱酸。以此得答案B。
注意:中和反应后溶液的酸碱性由两方面决定。该题给出c(H+)= c(OH—),故应从酸碱用量考虑。如未理解题意,极易从盐的水解进行分析,故易错选C、D。
若1体积硫酸恰好与10体积pH=11的氢氧化钠溶液完全反应,则二者物质的量浓度之比应为( )
| A.10:1 | B.5:1 | C.1:1 | D.1:10 |
1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于( C )
| A.9.0 | B.9.5 | C.10.5 | D.11.0 |
常温时,向pH =2的硫酸中加入等体积的下列溶液后,滴入甲基橙试液,出现红色,该溶液可能是
| A.pH ="12" 的Ba(OH)2 | B.pH =12的氨水 |
| C.0.005mol/L NaOH | D.0.05mol/LBaCl2 |
下列叙述正确的是()
| A. |
95℃纯水的
|
| B. |
|
| C. |
0.2
|
| D. |
|
室温下,下列混合溶液的PH一定小于7的是( )
A PH=3的盐酸和PH=11的氨水等体积混合
B PH=3的盐酸和PH=11的氢氧化钡等体积混合
C PH=3的醋酸和PH=11的氢氧化钡等体积混合
D PH=3的硫酸和PH=11的氨水等体积混合
下列溶液中各微粒的浓度关系或说法正确的是 A.0.1 mol•L-1 pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
A.0.1 mol•L-1 pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) B.等物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O;c(NH4+) 由大到小的顺序是:①>②>③>④
B.等物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O;c(NH4+) 由大到小的顺序是:①>②>③>④ C.amol·L-1HCN溶液与bmol·L-1NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b
C.amol·L-1HCN溶液与bmol·L-1NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b D.0.1mol·L-1的醋酸的pH=a,0.01mol·L-1的醋酸的pH=b,则a+1=b
D.0.1mol·L-1的醋酸的pH=a,0.01mol·L-1的醋酸的pH=b,则a+1=b
试题篮
()