下列溶液中Cl-的物质的量浓度与50 mL 1 mol/L AlCl3溶液中Cl-物质的量浓度相等的是
| A.75 mL 1.5 mol/L MgCl2溶液 | B.150 mL 2 mol/L KCl溶液 |
| C.100 mL 1 mol/L NaCl溶液 | D.25 mL 2 mol/L AlCl3溶液 |
下列说法正确的是
| A.1 mol任何气体的摩尔体积都约是22.4 L |
| B.标准状况时,体积均为22.4 L的O2与CO2含有相同的分子数 |
| C.处于标准状况的两种气体,当体积均为22.4 L时的质量完全相同 |
| D.标准状况时,2 mol任何物质的体积均约为44.8 L |
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系
如右图。反应中镁和铝的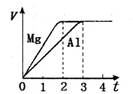
| A.物质的量之比为3:2 | B.质量之比为2:3 |
| C.摩尔质量之比为2:3 | D.反应速率之比为3:2 |
某老师批阅学生实验报告,下列哪些学生是以科学的态度记录实验数据的
| A.甲学生用50mL量筒量取46.70mL浓盐酸 |
| B.乙学生用广泛pH试纸测定溶液的酸碱性:pH=14.5 |
| C.丙学生配NaOH溶液,用电子天平称取固体1.220g |
| D.丁学生用酸式滴定管量取25.00mL 0.1mol/L的盐酸 |
右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是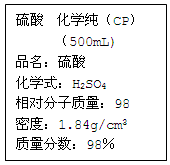
| A.该硫酸的物质的量浓度为9.2mol/L |
| B.1mol Zn与足量该硫酸反应产生2g氢气 |
| C.配制200mL 4.6mol/L的稀硫酸需取该硫酸50mL |
| D.该硫酸与等质量的水混合后所得溶液的浓度大于9.2mol/L |
以NA表示阿伏加德罗常数,下列说法错误的是
| A.每摩尔H2O2分子含2NA个氧原子 |
| B.标准状况下,22.4L水中含有NA个水分子 |
| C.16g甲烷分子中含4NA个氢原子 |
| D.100mL 1mol/L Na2SO4溶液含有0.2NA个Na+ |
下列测定常温下1mo1氢气体积的操作中,使结果偏大的是
| A.镁带中混有与酸不反应的杂质 | B.装置接口连接处有气体泄漏 |
| C.液体量瓶刻度读数未扣去硫酸的体积 | D.硫酸注入量不足,镁带未反应完全 |
下列有关物理量相应的单位表达错误的是
| A.摩尔质量:g/mol | B.气体摩尔体积:mol/L |
| C.溶解度:g/100gH2O | D.密度:g/cm3 |
用NA表示阿伏加德罗常数的值,下列说法正确的是
| A.Fe在少量C12中燃烧生成0.5 mol产物,转移的电子数为1NA |
| B.78g Na2O2晶体中含有的阴离子数目为2NA |
| C.在标准状况下,2.8g N2和2.8g CO所含电子数均为1.4NA |
| D.pH=13的NaOH溶液中含有的OH-的数目为0.1NA |
用固体烧碱配制0.4mol·L-1的NaOH溶液240mL:
(1)实验仪器:托盘天平(含砝码)、烧杯、玻璃棒、____________、____________。
(2)称量____________g的NaOH。
(3)称量烧碱的动作要迅速,原因是: _________ 。
(4)下列操作中,会使所配制溶液浓度偏高的是 。(选填字母序号)
| A.NaOH在烧杯中溶解后立即转移到容量瓶 |
| B.定容时俯视读数 |
| C.定容、摇匀、静置,发现液面低于刻线,再加水至刻度线 |
| D.容量瓶没有干燥即用来配制溶液 |
E.溶解烧碱的烧杯未洗涤
用NA表示阿伏加德罗常数,下列叙述正确的是
| A.在标准状况下,2.24LH2O中原子数为0.3NA |
| B.0.1mol/L 的NaCl溶液中,Na+与Cl-离子总数为0.2NA |
| C.16g O2和O3的混合气体中含NA个O原子 |
| D.64克铜与足量的硫反应生成硫化铜,理论上会转移2NA个电子 |
在一定条件下,将m体积NO和n体积O2同时倒立于水中且盛满水的容器内,充分反应后,容器内残留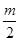 体积的气体,该气体与空气接触后变为红棕色。则m与n的比值为
体积的气体,该气体与空气接触后变为红棕色。则m与n的比值为
| A.3:2 | B.2:3 | C.8:3 | D.3:8 |
用NA表示阿伏加德罗常数,下列叙述不正确的是
| A.标准状况下,22.4LSO3含有的分子数NA |
| B.常温常压下,4.4gCO2的物质的量一定为0.1mol |
| C.标准状况下,氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24L |
| D.7.8gNa2S和7.8gNa2O2中含有的阴离子数目均为0.1NA |
试题篮
()